现代工业的飞速发展引起的水体重金属污染问题已十分严重, 亟待解决[1].其中水体铅污染会对人类以及水中生物的生存构成严重的威胁[2].目前, 对于水体重金属离子的去除有以下方法:化学沉淀法[3]、离子交换法[4]、吸附法[5, 6]、膜过滤法[7]、电化学处理技术[8]等.其中化学沉淀法由于操作简便和处理成本低并且效果较好而成为目前应用较为广泛的一种方法[9].有研究表明, 由于大多数重金属离子能与水中的磷酸根离子结合从而形成难溶于水的稳定化合物, 所以磷酸盐沉淀法是处理重金属离子污染十分有效的一种方法[10, 11, 12].鸟粪石作为一种磷酸盐类物质, 其通过沉淀溶解平衡释放的磷酸根离子可在一定条件下与水体中的重金属离子反应生成稳定的沉淀, 使水体中的重金属离子得到去除.
本研究所采用鸟粪石天然沸石复合材料(NZ-MAP材料)是由镁盐改性的天然沸石回收污水中氮磷后形成的鸟粪石天然沸石复合回收产物.研究表明, 该材料的回收过程实现了氮磷的资源化利用[13], 因此具备一定的环境修复能力[14].该材料具备以下优势:①天然沸石本身对水中的铅离子具有一定的吸附能力[15], 也可作为鸟粪石负载的骨架[16], 使其更容易从污水中富集回收, 有效地解决了鸟粪石回收困难的问题[17]. ②NZ-MAP综合了天然沸石对水体中铅离子的吸附能力和鸟粪石释放的磷酸根离子对铅离子的沉淀作用, 更加有效地实现了对水体中铅离子的去除[18].本研究以水体中重金属离子Pb2+为研究对象, 探究了NZ-MAP材料对水中Pb2+的去除效果, 以期为氮磷回收材料去除水中重金属提供了依据.
1 材料与方法 1.1 实验材料将天然沸石洗净烘干后, 按照m(Mg2+)/m(NZ)为1 :5加入MgCl2溶液.搅拌1 h后, 按照n(OH-)/n(Mg2+)为2.0, 缓慢滴加NaOH溶液, 振荡浸渍3 h后静置12 h.将上清液倒掉后把材料反复冲洗干净, 然后放入马弗炉中400℃焙烧5 h, 即制得负载氧化镁的天然沸石(NZ-MgO).将一定质量的NZ-MgO材料加入到氮磷浓度均为60 mg ·L-1混合模拟废水中, 后放在摇床中控制25℃、180 r ·min-1反应4 h, 抽滤后在40℃下烘干, 即得NZ-MAP材料.
1.2 实验方法 1.2.1 材料投加量优化准确称量0.01、0.02、0.04、0.06、0.08和0.10 g NZ-MAP材料, 分别将其投加到100 mL浓度为300 mg ·L-1 Pb2+溶液中, 调节溶液初始pH为5.0, 后放在摇床中控制25℃、180 r ·min-1反应4 h, 最后取上清液过0.22 μm滤膜.测定反应前后溶液中Pb2+的浓度, 计算吸附量.
1.2.2 溶液初始pH的影响准确称取0.04 g NZ-MAP材料数次, 将其分别投加到100 mL浓度为300 mg ·L-1重金属Pb2+溶液中, 依次调节溶液初始pH为2.0、3.0、4.0、5.0、6.0, 后放在摇床中控制25℃、180 r ·min-1反应4 h, 最后取溶液上清液过0.22 μm滤膜, 测定其Pb2+的浓度.
1.2.3 反应时间的影响准确称取0.04 g NZ-MAP材料数次, 将其分别投加到100 mL浓度为300 mg ·L-1重金属Pb2+溶液中, 调节溶液初始pH为5.0, 后放在恒温摇床控制25℃、180 r ·min-1反应, 每隔一定的时间取溶液上清液过0.22 μm滤膜, 测定其Pb2+的浓度.
1.2.4 共存重金属离子的影响分别配制Ni2+、Zn2+、Cu2+和Al3+的浓度梯度为25、50、75、100、125 mg ·L-1和Pb2+的混合溶液, 其中Pb2+的初始浓度为300 mg ·L-1.调节溶液初始pH为5.0, 后放在摇床中控制25℃、180 r ·min-1反应4 h, 然后取上清液过0.22 μm滤膜, 测定其Pb2+的浓度.
1.2.5 铅离子溶液的测定方法铅离子溶液的测定采用ICP光谱仪, 型号为ICP-Agilent 720ES.
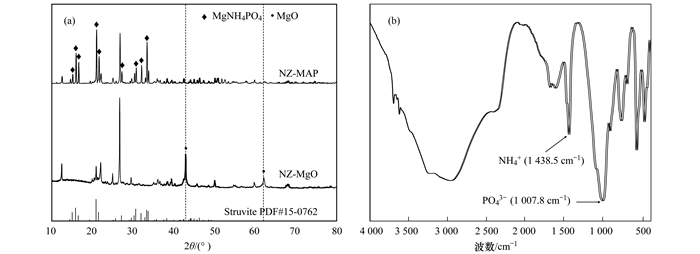
2 结果与讨论 2.1 氮磷回收产物的表征图 1(a)为最佳反应条件下的NZ-MAP的XRD图谱, 其表明回收产物NZ-MAP中MgO的特征峰消失, 在2θ角为15.81°、20.86°、21.45°和31.93°时出现了明显衍射峰, 与鸟粪石的标准谱图(PDF#15-0762)对比, 可发现两者所在强度峰的位置基本一致, 可基本确定回收产物上的主要成分为鸟粪石. 图 1(b)为在最佳反应条件下的NZ-MAP的FTIR图谱, 其表明在波数为1 007.8、571.2和471.6 cm-1处出现了明显的PO43-特征吸收峰, 在波数为1 438.55 cm-1处出现了NH4+的变形振动, 说明NZ-MAP中存在磷酸根离子和铵根离子.
|
(a)最优反应条件下回收产物的XRD图谱; (b)最优反应条件下回收产物的FTIR图谱 图 1 最优反应条件下的XRD图和FTIR图 Fig. 1 XRD diagram and FTIR diagram under optimal reaction conditions |
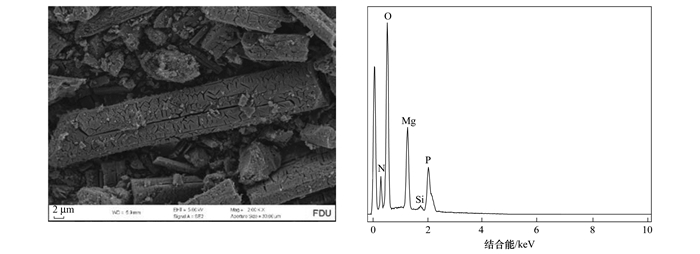
图 2为最佳条件下NZ-MAP的SEM/EDS图谱, 其表明NZ-MAP表面存在粗壮的棒状晶体, 表面存在明显的刻痕. 表 1为最优反应条件下回收产品EDS图谱元素质量比.从中可知, 鸟粪石晶体的构成元素Mg、O、N和P的质量比均较高.以上的分析结果表明, 回收材料NZ-MAP中含有大量的鸟粪石, 并且可以提供磷酸根离子, 对水体中铅离子进行吸附去除.
|
图 2 最优反应条件下回收产物的SEM/EDS图谱 Fig. 2 SEM/EDS atlas of recovery products under optimal reaction conditions |
|
|
表 1 最优反应条件下回收产品EDS图谱元素质量比 Table 1 Mass ratio of EDS atlas for recovered products under optimal reaction conditions |
2.2 材料投加量优化
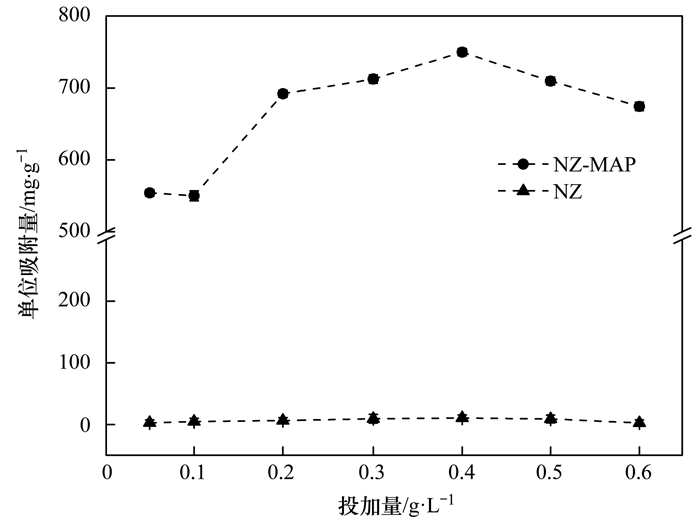
吸附剂的投加量是影响吸附特性的最重要因素[19]. 图 3为天然沸石NZ和NZ-MAP材料投加量对溶液中Pb2+吸附效果的影响.从中可知, 当天然沸石投加量在0.05~0.6 g ·L-1时, 天然沸石对溶液中Pb2+的单位吸附量稳定在8.2 mg ·g-1左右, 而在同样的投加量下, NZ-MAP对溶液中Pb2+的吸附能力明显变强, 说明NZ-MAP对Pb2+的吸附能力优于天然沸石.当投加量从0.05 g ·L-1增加到0.6 g ·L-1时, NZ-MAP的单位吸附量先增加后减小.在吸附剂的投加量为0.4 g ·L-1时, 单位吸附量最高, 为749.74 mg ·g-1, 是天然沸石的91倍; 当投加量大于0.4 g ·L-1时, NZ-MAP对溶液中Pb2+的单位吸附量开始下降, 这可能是由于此时溶液体系中吸附剂过量, 吸附剂NZ-MAP无法得到高效利用.因此NZ-MAP对溶液中Pb2+的去除的最佳投加量为0.4 g ·L-1.
|
图 3 材料投加量对溶液中Pb2+吸附效果的影响 Fig. 3 Effect of material dosage on Pb2+ adsorption in solution |
pH是影响吸附剂吸附效果的重要因素, pH通过影响吸附剂表面电荷和重金属在溶液中存在形式, 进而影响吸附剂的吸附效果[20]. 图 4为溶液初始pH对NZ-MAP吸附溶液中Pb2+的影响, Pb2+溶液初始pH范围设定在2.0~6.0之间.从中可知, 随着pH的增加, NZ-MAP对溶液中Pb2+的吸附量先迅速增加后趋于稳定, 在pH为4.0时达到稳定.当pH从2.0变化至4.0时, 单位吸附量从111.12 mg ·g-1增至749.87 mg ·g-1.分析可知, 当溶液pH较低时, 溶液中存在大量的H+和Pb2+争夺NZ-MAP表面带有负电荷的吸附点位, 形成有效竞争关系[21], 阻碍了NZ-MAP吸附溶液中的Pb2+.当溶液pH增大, 溶液中H+浓度相对减少, 一方面, NZ-MAP表面活性点位易于和Pb2+结合; 另一方面, 溶液中的Pb2+易于和NZ-MAP释放的HPO42-和H2PO4-形成沉淀, 反应方程如式(1)和式(2)所示, 从而表现出较好的吸附能力.
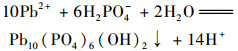
|
(1) |
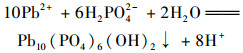
|
(2) |
|
图 4 初始pH对NZ-MAP吸附溶液中Pb2+的影响 Fig. 4 Effect of initial pH on Pb2+ in a NZ-MAP adsorption solution |
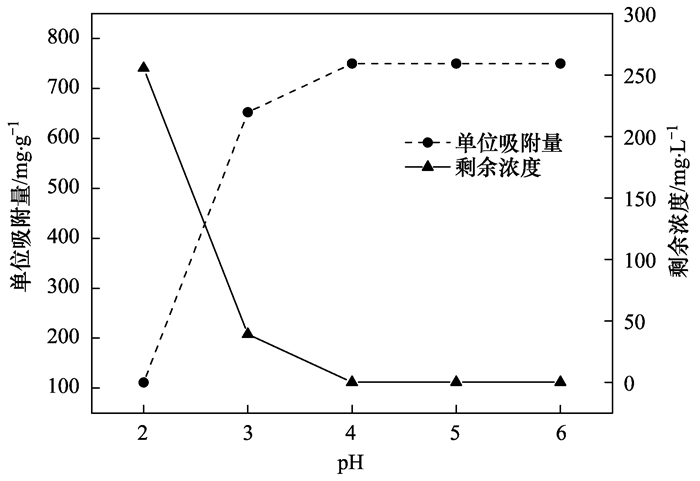
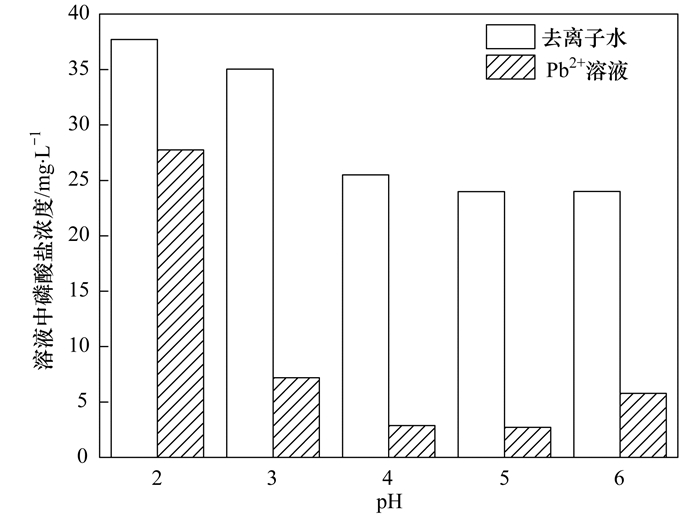
图 5为不同初始pH条件下, NZ-MAP在一定浓度Pb2+溶液中磷酸盐的释放情况.从中可知, 重金属溶液中磷酸盐浓度明显低于去离子水中磷酸盐的浓度, 这一定程度上说明了NZ-MAP所释放的磷酸盐和重金属发生了化学反应.为进一步探讨在不同初始pH条件下NZ-MAP对溶液中重金属的吸附机理, 对沉淀产物做XRD和SEM分析. 图 6为Pb2+溶液于不同pH条件下沉淀产物的XRD图谱, 其表明当初始pH为3.0、4.0、5.0、6.0时, 沉淀产物在2θ角为30.04°、31.328°和21.57°时出现明显的特征峰, 经与铅羟基磷灰石Pb10 (PO4)6 (OH)2的标准谱图(PDF#87-2477)对比, 这些特征峰所在的位置与铅羟基磷灰石Pb10 (PO4)6 (OH)2的主要强度峰所在位置基本相同, 故可基本确定沉淀产物含有Pb10 (PO4)6 (OH)2沉淀; 当pH为2时, 沉淀产物在2θ角为26.60°处出现强衍射峰, 此处为SiO2特征峰, 且并未出现明显的Pb10 (PO4)6 (OH)2衍射峰, 这说明沉淀产物几乎没有Pb10 (PO4)6 (OH)2沉淀. 图 7为Pb2+溶液于不同pH条件下沉淀产物SEM图谱.从中可知, Pb10 (PO4)6 (OH)2沉淀呈不规则的棒状结构, 当初始pH为2时, Pb10 (PO4)6 (OH)2晶体分布比较分散, 随着溶液pH的升高, Pb10 (PO4)6 (OH)2晶体逐渐出现团聚态的较为粗壮的棒状结构.
|
图 5 不同初始pH条件下, NZ-MAP在溶液中磷酸盐的释放情况 Fig. 5 Release of phosphate in solution from NZ-MAP under different initial pH conditions |
|
图 6 Pb2+溶液于不同pH条件下沉淀产物XRD图谱 Fig. 6 XRD spectra of precipitation products of a Pb2+ solution under different pH conditions |

|
(a)pH=2; (b) pH=3; (c) pH=4; (d) pH=5; (e) pH=6 图 7 Pb2+溶液于不同pH条件下沉淀产物SEM图谱 Fig. 7 SEM spectra of precipitation products of a Pb2+ solution under different pH conditions |
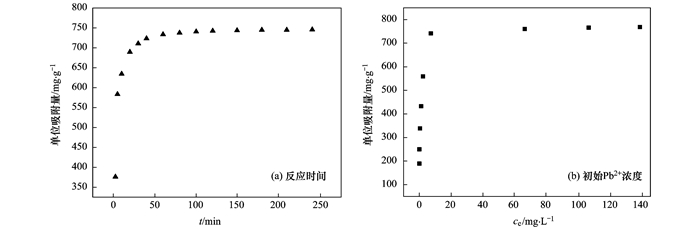
图 8(a)为NZ-MAP对Pb2+的吸附量随时间的变化.从中可知, 随着时间的增加, NZ-MAP对Pb2+的单位吸附量呈先增加后趋于平衡的趋势, 并且在前60 min单位吸附量增长迅速.这是因为在反应前期, 加入NZ-MAP后, 该材料迅速释放磷酸根离子, 与溶液中大量存在Pb2+结合, 形成沉淀.而在60 min后, 该反应体系中的反应物被消耗完, 所以60 min后的单位吸附量的增加不再明显, 只是略微有增加后迅速达到平衡, 平衡吸附量为745.70 mg ·g-1. 图 8(b)为NZ-MAP对Pb2+的吸附量随初始铅离子浓度的变化.从中可知, 当Pb2+浓度在20 mg ·L-1以下时, NZ-MAP对Pb2+的单位吸附量随着Pb2+的增加而增加, 当Pb2+浓度超过20 mg ·L-1时, 单位吸附量不再有明显变化, 说明在Pb2+浓度在20 mg ·L-1以下时, 随着Pb2+浓度增加, 有更多的铅离子吸附在材料上, 而当Pb2+浓度超过20 mg ·L-1时, 材料的吸附位点几乎达到饱和.
|
图 8 反应时间和初始Pb2+浓度对溶液中Pb2+吸附的影响 Fig. 8 Effect of reaction time and initial concentration Pb2+ on the adsorption of Pb2+ from solution |
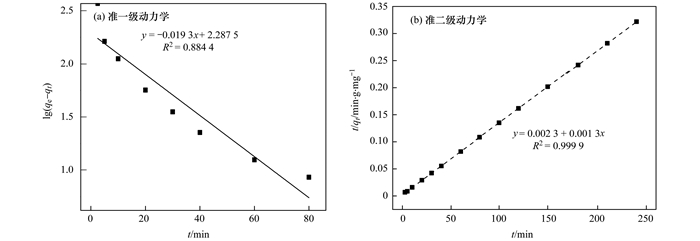
为了深入探讨NZ-MAP对溶液中Pb2+的吸附过程, 将NZ-MAP吸附Pb2+的数据进行准一级动力学模型和准二级动力学模型拟合, 图 9为NZ-MAP吸附Pb2+的准一级反应动力学和准二级反应动力学方程线性回归直线拟合的拟合结果, 其动力学参数如表 2所示.从中可知, 准二级动力学反应方程式拟合的qe与实际值较为接近, 准一级动力学和准二级动力学的相关系数分别为0.884 4和0.999 9, 所以NZ-MAP对溶液中Pb2+的吸附过程符合准二级动力学模型.
|
图 9 NZ-MAP吸附溶液中Pb2+的准一级反应动力学和准二级反应动力学方程拟合结果 Fig. 9 Quasi-primary reaction kinetics and quasi-two reaction kinetic equation fitting results of Pb2+ in NZ-MAP adsorption solution |
|
|
表 2 NZ-MAP对溶液中Pb2+的吸附动力学参数 Table 2 Adsorption kinetic parameters of NZ-MAP on Pb2+ in solution |
2.5 共存重金属离子的影响
通常情况下, 实际废水中重金属离子种类繁多、成分复杂[22].重金属离子之间易相互竞争以争夺NZ-MAP材料表面活性位点, 阻碍反应的进行.因此, 本研究选取工业废水中常见重金属离子作为研究对象, 以考察不同共存重金属离子(Ni2+、Zn2+、Cu2+和Al3+)对NZ-MAP吸附溶液中Pb2+的影响[23].
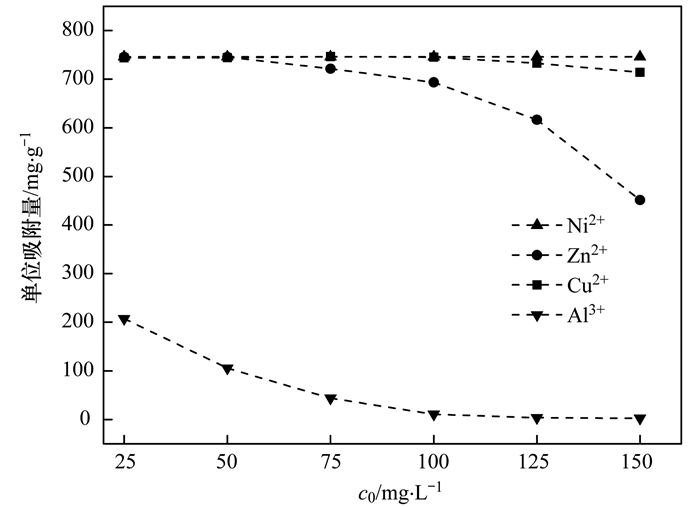
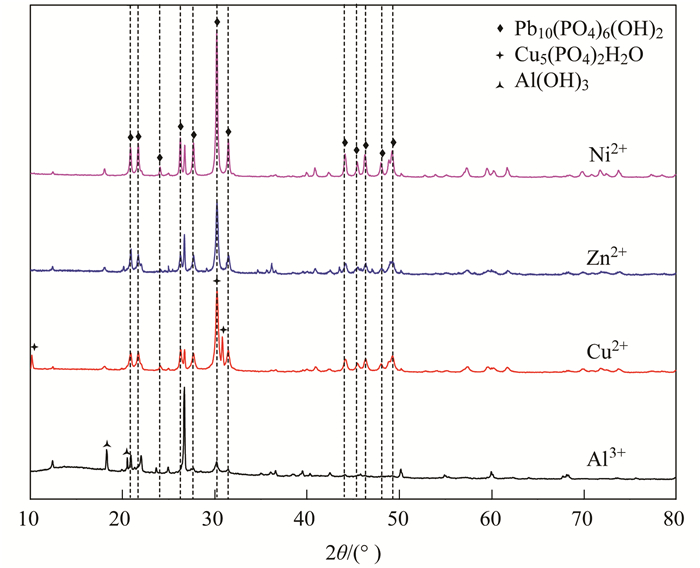
图 10为不同初始浓度重金属离子对NZ-MAP吸附溶液中Pb2+的影响.从中可知, 共存Ni2+和Cu2+对NZ-MAP吸附Pb2+的影响较小, 共存Zn2+和Al3+明显抑制了NZ-MAP对Pb2+的吸附作用, 且作用大小与投加浓度呈正相关关系.值得注意的是, 共存Al3+的抑制作用最为明显, 这可能是由于Al3+易发生水解生成Al(OH)3[24], 同时产生大量H+, 导致溶液pH降低并且H+和Pb2+产生竞争, 阻碍NZ-MAP对溶液中Pb2+的吸附. 图 11为在不同重金属离子共存条件下, NZ-MAP吸附Pb2+的沉淀产物XRD图谱, 从中可知, 共存Ni2+和Zn2+条件下的沉淀产物仍为Pb10 (PO4)6 (OH)2沉淀, 未出现其他重金属沉淀的特征峰; 共存Cu2+条件下的沉淀产物除了存在Pb10 (PO4)6 (OH)2晶体的特征峰外, 在10.16°、30.24°和30.82°处还出现了Cu3(PO4)2H2O晶体的特征峰[25]; 共存Al3+条件下的沉淀产物无明显的Pb10 (PO4)6 (OH)2晶体的特征峰, 仅出现了Al(OH)3晶体的特征峰[21]. 图 12为在不同重金属离子共存条件下, NZ-MAP吸附Pb2+的沉淀产物SEM图谱.从中可知, 共存Ni2+、Zn2+条件下的沉淀产物的形态为细小的短棒状结构, 存在明显的团聚现象; 共存Cu2+条件下的沉淀产物的形态为细长的针状结构; 而Al3+条件下的沉淀产物无特定形态.
|
图 10 不同初始浓度重金属离子对NZ-MAP吸附溶液中Pb2+的影响 Fig. 10 Effects of different initial concentrations of heavy metal ions on Pb2+ in NZ-MAP adsorption solution |
|
图 11 不同重金属离子共存条件下, NZ-MAP吸附Pb2+的沉淀产物XRD图谱 Fig. 11 Effects of different initial concentrations of heavy metal ions on Pb2+ in NZ-MAP adsorption solution |

|
图 12 不同重金属离子共存条件下, NZ-MAP吸附Pb2+的沉淀产物SEM图谱 Fig. 12 SEM spectra of precipitation products of NZ-MAP adsorbed Pb2+ under the coexistence of different heavy metal ions |
(1) 当Pb2+的初始浓度为300 mg ·L-1时, NZ-MAP的最优投加量分别为0.4 g ·L-1, 相对应的吸附量分别为749.74 mg ·g-1. NZ-MAP对溶液中Pb2+的吸附量随pH的增大呈先增加后趋于平衡的趋势, 在不同pH条件下, 回收产物的组分和形貌有一定的差异.
(2) 通过对回收产物进行XRD和SEM分析, NZ-MAP对溶液中Pb2+的去除主要是通过生成Pb10 (PO4)6 (OH)2沉淀的方式达到去除效果.
(3) 共存重金属离子对NZ-MAP去除溶液中Pb2+的影响从大到小排列依次是Al3+、Zn2+、Cu2+和Ni2+, 同时不同共存重金属离子对其回收产物的组分和形貌有一定的影响.
| [1] |
孙伟锋, 肖迪. 水体重金属污染现状及治理技术[J]. 能源与节能, 2012(2): 49-50. Sun W F, Xiao D. Status and control technology of heavy metal pollution[J]. Energy and Energy Conservation, 2012(2): 49-50. DOI:10.3969/j.issn.2095-0802.2012.02.026 |
| [2] |
于晓莉, 刘强. 水体重金属污染及其对人体健康影响的研究[J]. 绿色科技, 2011(10): 123-126. Yu X L, Liu Q. Research status of heavy metal pollution in waters and its effects on human health[J]. Journal of Green Science and Technology, 2011(10): 123-126. DOI:10.3969/j.issn.1674-9944.2011.10.062 |
| [3] |
王小丹, 铁绍龙. 纳米氧化锌的性能及其在涂料中的应用[J]. 电镀与涂饰, 2005, 24(3): 27-30. Wang X D, Tie S L. Performance of nano-ZnO and its applications in coatings[J]. Electroplating & Finishing, 2005, 24(3): 27-30. DOI:10.3969/j.issn.1004-227X.2005.03.009 |
| [4] |
朱一民, 王忠安, 苏秀娟, 等. 钙基膨润土对水相中铜离子的吸附[J]. 东北大学学报(自然科学版), 2006, 27(1): 99-102. Zhu Y M, Wang Z A, Su X J, et al. Adsorption of Cu2+ by Ca-bentonite in wastewater[J]. Journal of Northeastern University (Natural Science), 2006, 27(1): 99-102. DOI:10.3321/j.issn:1005-3026.2006.01.026 |
| [5] |
孟霞, 张旭东, 田燕, 等. 纳米材料在涂料中的应用[J]. 山东化工, 2004, 33(3): 19-21. Meng X, Zhang X D, Tian Y, et al. Application of nanomaterials in coatings industry[J]. Shandong Chemical Industry, 2004, 33(3): 19-21. |
| [6] | Afkhami A, Saber-Tehrani M, Bagheri H. Simultaneous removal of heavy-metal ions in wastewater samples using nano-alumina modified with 2, 4-dinitrophenylhydrazine[J]. Journal of Hazardous Materials, 2010, 181(1-3): 836-844. DOI:10.1016/j.jhazmat.2010.05.089 |
| [7] |
钟常明, 方夕辉, 许振良. 膜技术及其组合工艺在重金属废水中的应用[J]. 环境科学与技术, 2008, 31(8): 44-48. Zhong C M, Fang X H, Xu Z L. Membrane technology and its application in heavy metal wastewater treatment[J]. Environmental Science & Technology, 2008, 31(8): 44-48. DOI:10.3969/j.issn.1003-6504.2008.08.012 |
| [8] |
马楠, 刘华波, 谢鑫源. 天然矿物负载Fe/Co催化H2O2氧化降解阳离子红3R[J]. 环境科学, 2015, 36(2): 576-583. Ma N, Liu H B, Xie X Y. Oxidation of cationic red 3R in water with H2O2 catalyzed by mineral loaded with Fe/Co[J]. Environmental Science, 2015, 36(2): 576-583. |
| [9] | 黄万联. 试论电镀废水处理工艺[J]. 科技与企业, 2012(10): 107-108. |
| [10] | Park J H, Bolan N, Megharaj M, et al. Comparative value of phosphate sources on the immobilization of lead, and leaching of lead and phosphorus in lead contaminated soils[J]. Science of the Total Environment, 2011, 409(4): 853-860. DOI:10.1016/j.scitotenv.2010.11.003 |
| [11] | Huang H M, Xu C L, Zhang W. Removal of nutrients from piggery wastewater using struvite precipitation and pyrogenation technology[J]. Bioresource Technology, 2011, 102(3): 2523-2528. DOI:10.1016/j.biortech.2010.11.054 |
| [12] |
刘羽, 彭明生. 磷灰石在废水治理中的应用[J]. 安全与环境学报, 2001, 1(1): 9-12. Liu Y, Peng M S. Applications of mineral apatites in the treatment of waste water[J]. Journal of Safety and Environment, 2001, 1(1): 9-12. DOI:10.3969/j.issn.1009-6094.2001.01.002 |
| [13] | Feng Y, Gong J L, Zeng G M, et al. Adsorption of Cd (Ⅱ) and Zn (Ⅱ) from aqueous solutions using magnetic hydroxyapatite nanoparticles as adsorbents[J]. Chemical Engineering Journal, 2010, 162(2): 487-494. DOI:10.1016/j.cej.2010.05.049 |
| [14] |
成雪君, 王学江, 王浩, 等. 载镁天然沸石复合材料对污水中氮磷的同步回收[J]. 环境科学, 2017, 38(12): 5139-5145. Cheng X J, Wang X J, Wang H, et al. Simultaneous recovery of nutrients from wastewater by mesoporous MgO-loaded natural zeolital[J]. Environmental Science, 2017, 38(12): 5139-5145. |
| [15] | Mier M V, Callejas R L, Gehr R, et al. Heavy metal removal with mexican clinoptilolite::multi-component ionic exchange[J]. Water Research, 2001, 35(2): 373-378. DOI:10.1016/S0043-1354(00)00270-0 |
| [16] | Demirbas A. Adsorption of lead and cadmium ions in aqueous solutions onto modified lignin from alkali glycerol delignication[J]. Journal of Hazardous Materials, 2004, 109(1-3): 221-226. DOI:10.1016/j.jhazmat.2004.04.002 |
| [17] | Ganzagh M A A, Yousefpour M, Taherian Z, et al. The removal of mercury (Ⅱ) from water by Ag supported on nanomesoporous silica[J]. Journal of Chemical Biology, 2016, 9(4): 127-142. DOI:10.1007/s12154-016-0157-5 |
| [18] | Ho Y S. Effect of pH on lead removal from water using tree fern as the sorbent[J]. Bioresource Technology, 2005, 96(11): 1292-1296. DOI:10.1016/j.biortech.2004.10.011 |
| [19] | Han R P, Lu Z, Zou W H, et al. Removal of copper (Ⅱ) and lead (Ⅱ) from aqueous solution by manganese oxide coated sand:Ⅱand lead (Ⅱ) from aqueous solution by manganese oxide coated sand:Ⅱ.Equilibrium study and competitive adsorption[J]. Journal of Hazardous Materials, 2006, 137(1): 480-488. DOI:10.1016/j.jhazmat.2006.02.018 |
| [20] |
周莹, 潘纲, 陈灏. 土壤原位覆盖对底泥的修复作用研究[J]. 环境工程学报, 2011, 5(11): 2459-2463. Zhou Y, Pan G, Chen H. Effect of in-situ capping on contaminated sediment remediation using local soil[J]. Chinese Journal of Environmental Engineering, 2011, 5(11): 2459-2463. |
| [21] | Hamidian A H, Atashgahi M, Khorasani N. Phytoremediation of heavy metals (Cd, Pb and V) in gas refinery wastewater using common reed (Phragmitis australis)[J]. International Journal of Aquatic Biology, 2014, 2(1): 29-35. |
| [22] | Wang H, Wang X J, Ma J X, et al. Removal of cadmium (Ⅱ) from aqueous solution:a comparative study of raw attapulgite clay and a reusable waste-struvite/attapulgite obtained from nutrient-rich wastewater[J]. Journal of Hazardous Materials, 2017, 329: 66-76. DOI:10.1016/j.jhazmat.2017.01.025 |
| [23] |
周平, 黄汝常, 李永辉, 等. 去除废水中重金属离子的新工艺研究[J]. 中国给水排水, 2015, 14(4): 17-20. Zhou P, Huang R C, Li Y H, et al. Study of a novel process for removal of heavy metals from industrial wastewater[J]. China Water & Wastewater, 2015, 14(4): 17-20. |
| [24] | 蒲文斌. 给水深度处理技术在城市水厂中的应用[J]. 建材与装饰, 2017(2): 266-267. |
| [25] | Wang H, Wang X J, Chen J, et al. Recovery of nutrients from wastewater by a MgCl2modified zeolite and their reuse as an amendment for Cu and Pb immobilization in soil[J]. RSC Advances, 2016, 6(61): 55809-55818. DOI:10.1039/C6RA12169A |
 2019, Vol. 40
2019, Vol. 40


