2. 中国科学院生态环境研究中心环境化学与生态毒理学国家重点实验室, 北京 100085
2. State Key Laboratory of Environmental Chemistry and Ecotoxicology, Research Center for Eco-Environmental Sciences, Chinese Academy of Sciences, Beijing 100085, China
多溴联苯(polybrominated biphenyls,PBBs)是一类新型持久性有机污染物(POPs),结构式如图 1所示. 2009年颁布的《关于持久性有机污染物的斯德哥尔摩公约》受控名单中新增了9种POPs,作为溴系阻燃剂之一的多溴联苯被列入其中. PBBs有209种同系物,用作阻燃剂的主要是六溴、 八溴、 九溴和十溴化合物[1]. 很多国家对PBBs的使用进行了严格的控制,甚至完全禁止使用,但PBBs本身具有非常稳定的化学结构和高度的憎水性,苯环上的溴原子导致其难以被氧化降解[2],因此仍在环境中大量存在. Sjdin等[3]在对美国人体血清PBBs含量的研究中,发现年龄超过56岁以上人群的人体血清PBBs含量最高,PBBs平均含量为2.7 ng ·g-1. 在南非开普敦某河流采集的污水处理厂排放口、 上游及下游水样中,BB153在排放口、 上游及下游水中总体平均浓度[4]分别为4.85、 0.25和1.56 ng ·L-1. 电子垃圾等废弃物的堆放、 拆解与焚烧是PBBs的一类重要污染来源. Benbow等[5]的研究报道了含废弃物的焚烧会导致PBBs的释放,Wang等[6]在城市固体废弃物焚烧飞灰中检测到了5种PBBs单体:BB-15、 BB-52、 BB-153、 BB-180和BB-194. 牟义军等[7]研究了我国某地电子废物处置场周边土壤中10种多溴联苯单体含量,10种PBBs含量平均值为2.50×10-3 mg ·kg-1,其中BB209在10种PBBs中所占比例最高. PBBs在环境介质中大量存在,已成为重大的安全隐患问题,尽管关于PBBs在环境中的分布、 迁移、 生物体内的转化和毒理方面的研究已有很多报道[8, 9, 10],但对其进行消减以及反应机制的研究还很少,因此开发针对PBBs的消减技术及其机制研究显得尤为迫切.
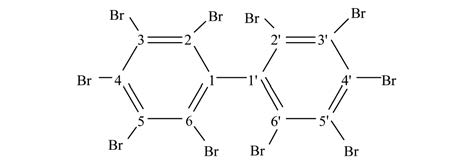 | 图 1 BB209结构式 Fig. 1 Chemical structure of BB209 |
金属及其氧化物对氯代芳烃的降解,凭其经济、 安全、 有效的特点,近年来受到了广泛地关注[11, 12, 13, 14, 15]. Fe3 O4属于反向的尖晶石结构,具有良好的导电性和强磁性[16]. 微/纳米Fe3 O4不但具备了微/纳米材料比表面积大、 反应活性高等优点还结合了较强的磁性特征可利于回收,因此被广泛地应用于氯代有机物的催化降解中[17]. 方国东等[18]采用纳米Fe3 O4降解水溶液中的2,4-二氯苯氧乙酸(2,4-Dichlorophenoxyacetic acid,2,4-D),结果表明纳米Fe3 O4对2,4-D的降解机制是还原脱氯. Jia等[17]利用多元醇介导自组装的方法成功制备出3种铁的花朵状三维纳米材料,探究了对六氯苯的热催化降解活性,Fe3 O4呈现出最快的降解速度,其降解速率常数为0.959 min-1. Su等[19]研究了300℃下Fe3 O4对八氯萘(octachloronaphthalene,CN-75)的降解活性和反应机制,发现Fe3 O4对八氯萘的降解具有很高的催化活性,且反应符合准一级动力学方程. 本课题组前期探究了利用Fe3 O4纳米材料对十氯联苯(polychlorinated biphenyl,PCBs)的降解[20],在降解温度为300℃时,反应30 min,Fe3 O4对十氯联苯的降解效率已达到90%以上. 另外,PBBs的结构、 持久性、 生物蓄积性以及毒性等与PCBs相似,因此在此研究基础上本文利用多元醇介导自组装的方法制备出了哑铃状形貌的Fe3 O4,对多溴联苯的模型污染物BB209进行降解,探究其活性大小. 利用GC-MS对BB209的降解产物进行检测分析,从而推测出BB209在Fe3 O4材料表面发生的降解机制.
1 材料与方法 1.1 材料的制备与表征利用多元醇盐介导自组装的方法制备自组装Fe3 O4微/纳米材料. 将金属离子浓度为25 mmol ·L-1的Fe(NO3)3 ·9H2O、 0.498 g 聚乙烯吡咯烷酮(PVP)加入到60 mL乙二醇(EG)中(所有试剂均为分析纯). 搅拌,油浴加热到230℃. 液体颜色变色后冷凝回流60 min. 待溶液冷却至室温,将沉淀用无水乙醇离心洗涤四遍. 置于80℃的烘箱中干燥6 h,即可得到Fe3 O4前驱体. 将Fe3 O4前驱体放入管式炉中,以60 mL ·min-1的速率通入氮气,加热至350℃,恒温3 h,冷却至室温即可得到Fe3 O4.
样品的晶型、 结构等利用荷兰PANalytical X'Pert Pro型X射线粉末衍射仪进行观察,入射光源为Cu Kα辐射,管电压40 kV,管电流40 mA,扫描范围20°-80°,扫描速率8(°) ·min-1. 催化剂样品表面的微观形貌使用日本日立公司的SU-8020型场发射扫描电子显微镜(SEM)进行表征,加速电压为5.0 kV. 利用JEM-2100F透射电子显微镜进行HRTEM观察,工作电压为200 kV. 热重差热分析采用Q600热重差热联合测定仪分析,升温速率为10℃ ·min-1,升温至1 000℃. 利用傅立叶红外光谱仪(Varian 3100 FT-IR)测定红外光谱图. 利用美国麦克公司ASAP2020型比表面测试仪进行样品比表面的测定.
1.2 降解实验选取BB209作为目标污染物评价自组装Fe3 O4微/纳米材料的活性. BB209购自德国Dr Ehrenstorfer公司(Dr Ehrenstorfer GmbH),正己烷和二氯甲烷购自美国Tedia公司(Fairfield,USA).
将0.2 mg BB209分别与20 mg Fe3 O4混合,置于一端封闭的玻璃管内,用酒精喷灯将另一端封闭,制成体积约为1 mL的样品管. 振荡后置于马弗炉内于不同温度(200、 250、 300、 350℃)加热反应适当时间(10、 20、 30 min). 以上所有实验均重复3次以确保实验结果的可靠性.
反应结束后,将样品管用铝箔纸包裹严实,用铁锤敲碎后用正己烷和二氯甲烷混合溶液(1 ∶1)进行萃取. 采用6890/5973N GC-MS对产物进行分析(DB-5MS石英毛细管柱:15 m×0.25 mm×0.10 μm).
采用降解率作为衡量催化剂对BB209降解效果的主要指标.
降解率按照公式(1)计算:
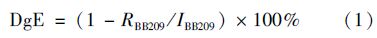
利用多元醇盐介导自组装的方法制备自组装Fe3 O4前驱体. 为了了解Fe3 O4前驱体的形成过程,将形成沉淀的时间记为计时零点,在不同的反应时间收集沉淀,探究了前驱体形貌与时间的关系. 前驱体随时间变化的SEM图片如图 2所示. 前驱体在反应的初始阶段为无形貌的沉淀物; 反应进行到15 min时形成了纳米级小颗粒; 当反应进行到30 min时有少量哑铃状形貌前驱体形成,但还存在其他未长成形的前驱体; 反应继续进行到45 min时即形成大量哑铃状前驱体; 哑铃状前驱体继续长大,当反应进行到60 min时完全生成饱满的哑铃状前驱体. Zhong等[21]制备的自组装花朵状三维铁氧化物纳米材料,在生长过程中形成稳定形态的时间小于45 min.
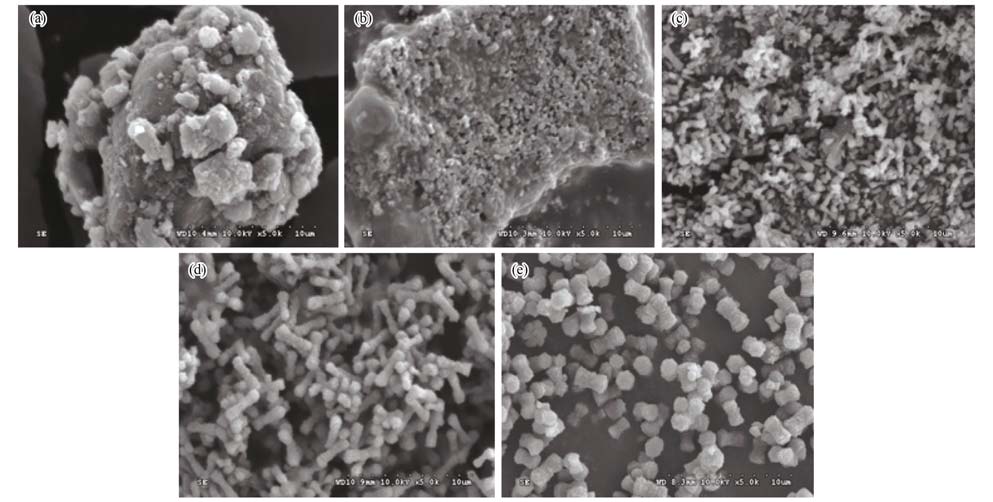 | (a) 0 min; (b) 15 min; (c) 30 min; and (d) 45 min; (e) 60 min图 2 前驱体随时间变化的形成过程 Fig. 2 SEM images of the as-prepared iron oxide precursors collected at different intervals since the precipitate occurred |
根据以上前驱体随时间变化的形成过程SEM表征结果,选取反应时间为60 min的Fe3 O4前驱体产物进行了XRD表征,如图 3所示,在低角度处10°、 12°、 18°分别有明显的衍射峰,表明在前驱体形成过程中生成了金属醇盐类物质[22, 23, 24],特别是在10°、 12°表现出很强的衍射峰进一步说明在EG中发生了低聚反应[25].
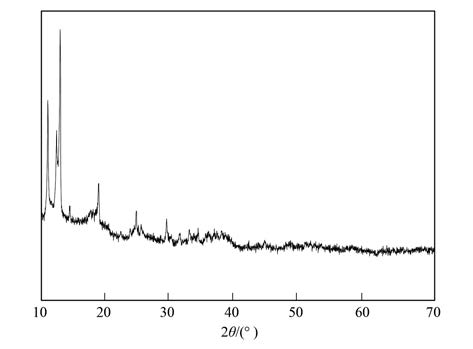 | 图 3 Fe3 O4前驱体的XRD图 Fig. 3 XRD patterns of iron oxide precursors |
图 4(a)为哑铃状Fe3 O4前驱体(反应时间为60 min)的傅里叶变换红外光谱图,表明前驱体在形成过程中可能发生的反应. 在3 302 cm-1处的伸缩振动的吸收峰是—OH,是水分子的羟基振动所产生[26],说明金属氧化物表面存在羟基和/或吸附水; 2 929.4 cm-1和2 856.6 cm-1的伸缩振动峰是CH2,在1 071 cm-1处是—CO—; 在1 372 cm-1和890 cm-1的强吸收峰为—NO2和—NH,表明硝酸铁中的NO3-可能与EG发生反应,这进一步验证了上述XRD的实验结果. 另外,在1 665 cm-1检测到的伸缩振动峰为C O,在1 297 cm-1的伸缩振动峰为PVP的C—N[27],由于PVP具有五元环侧基,存在较大的空间位阻,因此在Fe3 O4前驱体形成过程中有可能起到了有效的稳定分散的作用[28].
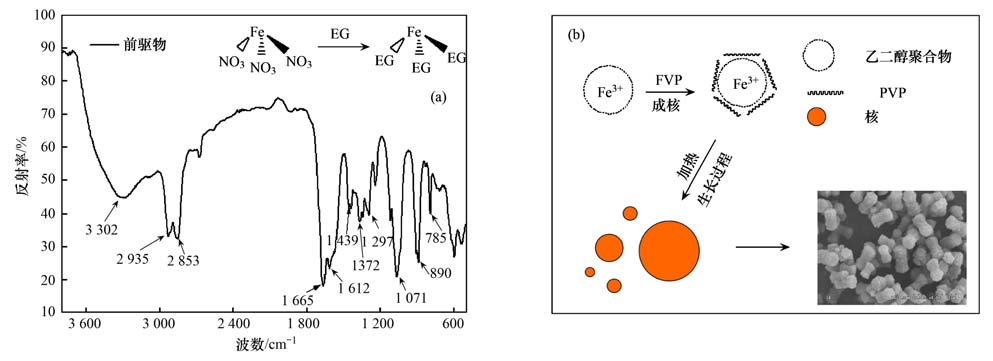 | (a)傅里叶变换红外光谱; (b)前驱体生长过程示意 图 4 在反应过程中前驱体的傅里叶变换红外光谱和前驱体生长过程示意 Fig. 4 FT-IR spectra of precursor and reaction formula in the synthesis process and Schematic Illustration for the Growth Process of the precursor |
根据以上前驱体随时间变化的SEM、 XRD表征结果以及FT-IR的实验结果,推测出前驱体的形 成过程如图 4(b)所示. 哑铃状前驱体的生长过程分为两个阶段,第一阶段为无定型粒子的快速成核过程; 第二阶段为初级粒子相互团聚结晶过程[29]. 在成核阶段,金属离子过度饱和以及成核过于快速,形成的是无定形的金属醇盐[30]. 在PVP的作用之下,随着配位过程的进行以及乙二醇与铁离子发生的醇解反应,核体逐渐长大形成规则球体,最终形成更为稳定的晶相[31]. Spalla等[32]在二氧化铈粒子分散体系中添加PVP后,对形成盐类的稳定性进行了研究,发现添加PVP后形成了稳定的金属盐. 在核体生长阶段,由于温度较高,晶相生长迅速,形成了许多成核中心,阻止了单一的成核中心导致材料 生长过大,使核体最终形成了具有特定结构的自组装微/纳米结构. Zhong等[33]制备出的三维花朵状二氧化铈微/纳米材料的生长过程也分为两个生长阶段.
2.2 Fe3 O4的表征图 5(a)为Fe3 O4前驱体的HRSEM图片,表明哑铃状前驱体是由直径约为1 μm、 长约为2 μm的片状结构堆积而成. 多层花状片层堆积形成单个片层结构,这些单个片层彼此连接最终形成哑铃状结构. 前驱体的TEM数据如图 5(b)所示,表明前驱体的结构较为紧密. 图 5(c)所示的EDX分析显示,哑铃状前驱体由碳、 氧、 铁这3种元素组成(硅元素来自于实验过程中负载样品的硅片).
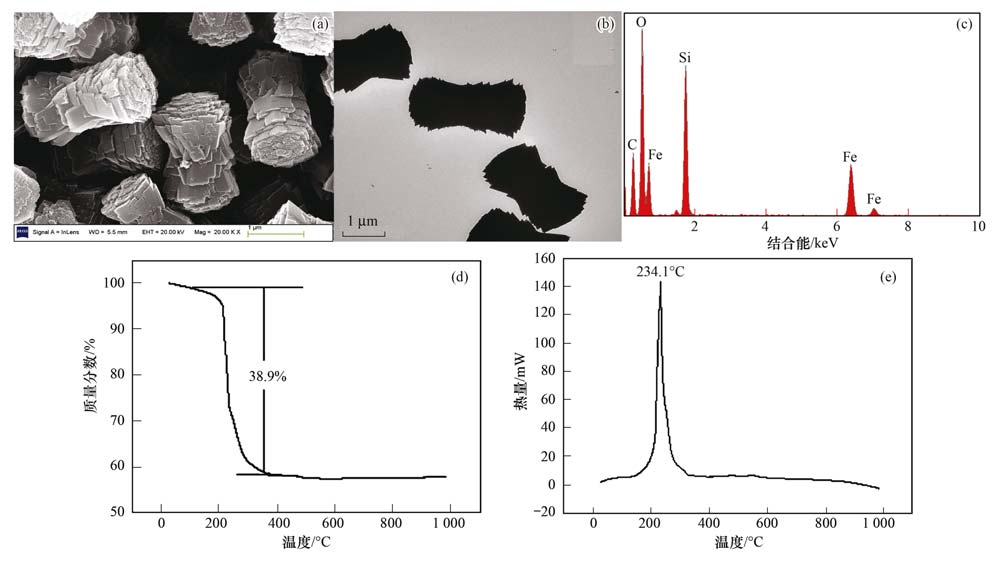 | (a)HRSEM图片;(b)TEM图片;(c)EDX元素分析;(d)和(e)TG-DSC分析 图 5 哑铃状前驱体 Fig. 5 Dumbbell-like iron oxide precursors |
 | (a)HRSEM图片; (b)TEM图片; (c)XRD谱图 图 6 焙烧后Fe3 O4的HRSEM、 TEM和XRD谱图 Fig. 6 HRSEM image,TEM image,and XRD patterns of Fe3 O4 after calcination |
为考察Fe3 O4前体物的热稳定性,从而确定Fe3 O4最佳的焙烧温度,对哑铃状前驱体进行了热失重(TG)分析和差示扫描量热分析(DSC). 由图 5(d)、 5(e)可知,哑铃状前驱体在整个加热过程中出现的失重峰主要集中在234℃左右,第一个失重峰主要是由材料间吸收水的挥发引起,第二个失重峰处于240℃与350℃之间,失重为38.9%,原因可能是由于样品的有机组分发生燃烧分解所致. 当温度达到350℃时,材料几乎已没有质量损失,说明前驱体在350℃时已完全分解. 差示扫描量热分析显示在234℃处出现的强放热峰是由于样品中有机组分发生燃烧放热所致,与样品的失重温度相符合.
在适当的温度下热解醇盐可以得到相应的氧化物,由热分析结果可知对前驱体在350℃条件下焙烧是可行的. 将Fe3 O4前驱体置于管式炉中,以60 mL ·min-1的速率通入氮气,加热至350℃,恒温3 h,冷却至室温得到Fe3 O4. 焙烧后材料的形貌如图 6(a)所示,焙烧后的材料仍是片层结构,表明焙烧并未改变其晶型的生长. 图 6(b)显示了Fe3 O4的TEM照片,焙烧后Fe3 O4结构不再紧密,出现了较多孔隙,验证了Fe3 O4中有机组分焙烧去除后,粒子间相互连接,纳米微粒之间出现孔隙,形成了哑铃状孔隙片层结构,由此证明哑铃状Fe3 O4是一种典型的微/纳米结构材料,可兼具纳米结构和微米结构的特性和优势. 所制Fe3 O4的XRD谱图如图 6(c)所示,结果表明350℃焙烧后得到的材料为纯相的Fe3 O4(JCPDS85-1436). Fe3 O4的比表面积为68 m2 ·g-1,Jia等[17]报道的市售Fe3 O4粉末的比表面积为6 m2 ·g-1,Zhong等[21]报道的自组装三维花朵状Fe3 O4的比表面积为34 m2 ·g-1,与其相比哑铃状Fe3 O4具有较高的比表面积.
2.3 自组装哑铃状Fe3 O4降解BB209催化剂的活性通过对BB209的降解率来评价,采用公式(1)计算,首先考察了300℃时Fe3 O4对BB209在不同反应时间下的降解率,实验结果如图 7(a)所示,随着反应时间的增长,其降解率也随之提高. 反应时间为30 min时,BB209的降解率已几乎达到100%; 此外还考察了温度对Fe3 O4降解BB209的影响,当反应时间为30 min时,不同反应温度下获得的降解率如图 7(b)所示. 降解率随着反应温度的升高而逐步提高. 在200-300℃之间降解率的变化非常明显; 当反应温度为300℃时,降解率已几乎达到100%. 空白实验在不同温度和反应时间下,对BB209的降解率在4%-12%之间,与上述实验对比发现,添加催化剂能有效提高BB209的降解. 与本文中哑铃状Fe3 O4相比,刘琪等[34]研究了Raney Ni催化TeBB加氢脱溴反应,发现反应时间为2 h时,在催化剂用量相同的条件下,Raney Ni对TeBB脱溴降解率接近100%. Chen等[35]合成了一系列Mn-Ce-Co复合金属氧化物用以降解4,4′-二溴联苯,其中Mn0.1Ce1Co0.9复合氧化物在反应温度为340℃时反应30min,降解率在90%左右. Hayashi等[36]的报道指出比表面积大的催化剂拥有较高的反应活性. Wang等[37]发现异丙醇在γ-Al2O3表面会分解,这是由于这种材料的结构缺陷性,选择性脱氢作用的发生是由于γ-Al2O3表面的基本位点,且具有一定浓度的晶体中的空位,结果表明,高比表面积的γ-Al2O3粉末拥有空位和其他不饱和的位点,这些位点可以吸附污染物并对其进行较快的降解. 因此结合2.2节中哑铃状Fe3 O4的孔隙片层结构以及比表面积的测定结果推测,哑铃状Fe3 O4对BB209之所以具有较高的降解活性,是因为特殊的哑铃状孔隙片层结构使Fe3 O4具有较大的比表面积,从而表面具有较多的活性位点和空位,可吸附更多的BB209,进而对其降解.
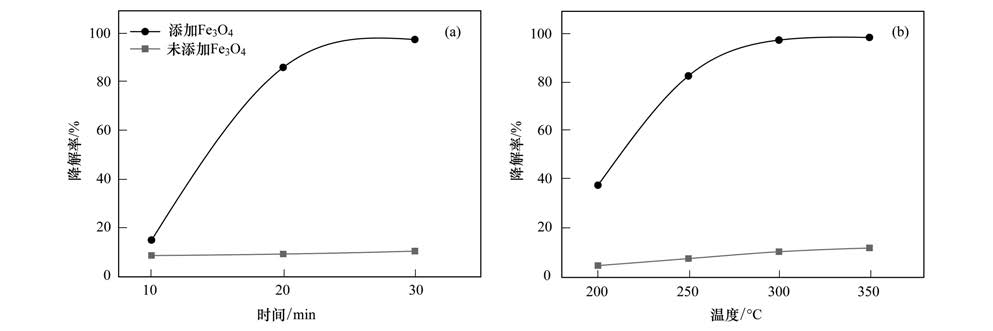 | 图 7 不同反应时间和不同反应温度下Fe3 O4对BB209的降解率 Fig. 7 Degradation efficiency of BB209 by Fe3 O4 with different reaction time and temperature |
为了考察材料反应后的热稳定性能,本研究对反应后的材料进行了表征. 图 8为反应后材料的TEM图片,发现降解反应并没有改变材料的哑铃状形貌,说明自组装哑铃状Fe3 O4微/纳米材料具有较好的热稳定性.
 | 图 8 300℃条件下与BB209反应30 min后Fe3 O4的TEM图 Fig. 8 TEM image of Fe3 O4 after reaction with BB209 at 300℃ for 30 min |
降解产物的GC-MS色谱图如图 9所示. 利用GC-MS检测到的产物主要包括九溴联苯(NoBB)、 八溴联苯(OcBB)、 七溴联苯(HpBB)、 六溴联苯(HxBB)、 五溴联苯(PeBB)、 四溴联苯(TeBB)、 三溴联苯(TrBB)、 二溴联苯(DBB)和一溴联苯(MBB)以及联苯(BB),一系列多溴联苯类以及联苯产物的生成,证明BB209在Fe3 O4材料表面发生了加氢脱溴降解反应. 表 1列出了不同反应时间条件下Fe3 O4降解BB209的降解产物的量,随着反应时间的延长,九溴联苯(NoBB)和八溴联苯(CoBB)产物的量逐渐减少; 但是从三溴联苯(TrBB)到七溴联苯(HpBB)产物的量随反应时间的延长呈现先增加后减小的趋势. 以上结果进一步验证了BB209在Fe3 O4材料表面发生了逐级加氢脱溴降解反应. 刘莎等[38]在利用市售的MgO降解PCBs的研究中,发现在降解过程中发生了加氢脱氯路径,检测到了两种九氯联苯(NoCB)单体:CB207、 CB208; 五氯苯(PeCB); 3种四氯苯(TeCB)单体:1,2,3,5-TeCB、 1,2,4,5-TeCB、 1,2,3,4-TeCB. Murena等[39]研究了Ni-Mo/γ-Al2O3在降解PCBs过程中可能发生的反应路径,发现在此反应体系中存在逐级加氢脱氯反应. Yamada等[40]在光解HCB的研究中也发现了相似的加氢脱氯反应路径.
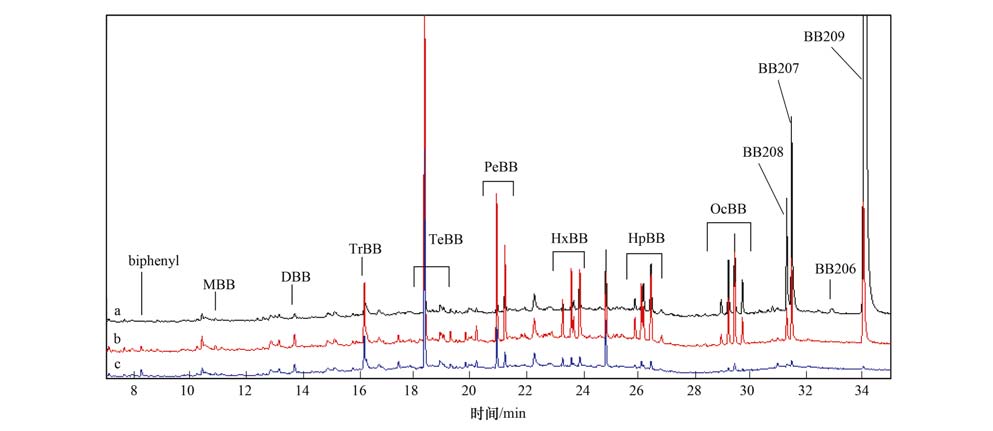 | a.10 min; b.20 min; c.30 min 图 9 300℃不同反应时间条件下Fe3 O4降解BB209的降解产物GC-MS色谱图 Fig. 9 GC-MS chromatogram showing the degradation products following decomposition of BB209 with Fe3 O4 nanomaterials at 300℃ for various reaction time |
|
|
表 1 不同反应时间Fe3 O4降解BB209生成的降解产物的量 1)/nmol Table 1 Hydrodechlorination products of BB209 by Fe3 O4 with various reaction time/nmol |
由前面的分析结果可知,BB209在Fe3 O4材料表面发生了逐级加氢脱溴降解反应,生成了一系列加氢脱溴降解产物. PBBs理论上有209种同系物,其结构和性质非常相似[41],由于缺少外标,难以对所产生的所有低溴代产物的具体的取代位置进行确定. 目前本研究中只确定了3种NoBB产物,包括BB206、 BB207、 BB208这3种单体,不同反应时间条件下,3种单体的生成量如图 10所示,3种单体的量的大小顺序为:BB207>BB208>BB206,表明BB209在Fe3 O4材料表面降解时,不同取代位上Br的活性相对大小为:间位>对位>邻位. Huang等[20]研究发现CB209在Fe3 O4材料表面降解时,生成的3种九氯联苯单体量呈现相同的大小关系: CB207>CB208>CB206,这是由C—Cl解离能的大小以及分子轨道能量差的大小共同决定的. Wu等[42]研究发现一氯苯在降解过程中具有同样的脱氯顺序,可能是由于空间位阻效应所致[19].
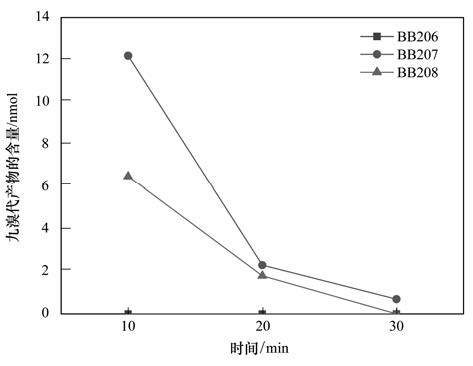 | 图 10 在不同反应时间时降解产物BB206、 BB207和BB208的生成量 Fig. 10 Amount of the detected BB206,BB207 and BB208 at different reaction time |
Lin等[43]发现利用Co3O4降解1,2,4-TrCB产生了相似的加氢脱氯路径. 因此推测BB209脱去溴原子的难易程度可能与C—Br解离能的大小、 分子轨道能量差的大小及空间位阻效应都有一定关系. 除了低取代的溴联苯产物,还检测到部分的完全脱溴的BB产物. 刘琪等[34]利用Raney Ni催化降解TeBB过程中,TeBB完全脱溴,生成产物为联苯.
根据前面的分析结果可知,BB209在Fe3 O4材料表面发生了逐级加氢脱溴反应,并确定出其中NoBB的3种单体BB206、 BB207、 BB208的相对含量,主要的加氢脱氯路径可以通过每一级最主要的脱氯产物的确定来推测[40]. 因此BB209在Fe3 O4中的主要加氢脱溴路径为BB209 BB207 OcBB … MBB BB,如图 11所示.
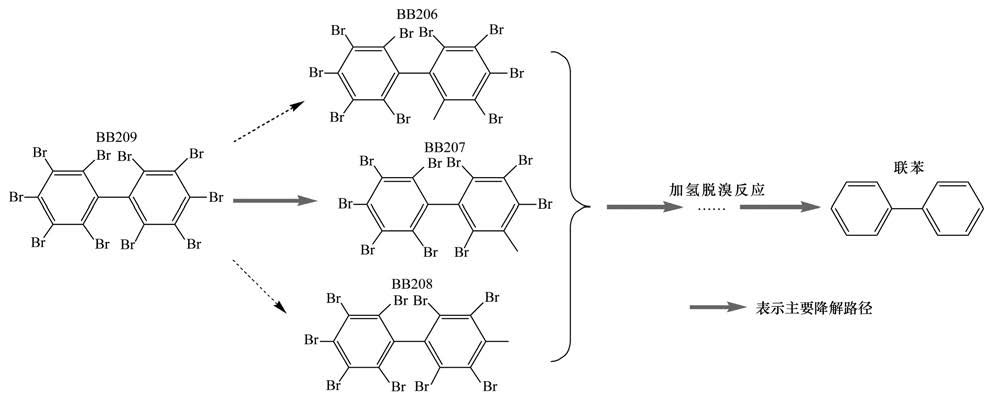 | 图 11 Fe3 O4降解BB209的加氢脱溴反应途径 Fig. 11 Hydrodebromination pathways proposed for BB209 degradation by Fe3 O4 |
(1)利用多元醇介导法制备出哑铃状形貌的Fe3 O4微/纳米材料的前驱体. 通过SEM、 XRD、 FT-IR等手段对前驱体形成过程的研究表明:随着反应时间的增加,前驱体的生长过程经历不规则形貌,最终逐渐形成规则形貌. 在前驱体形成过程中生成了金属醇盐类物质. 哑铃状的Fe3 O4微/纳米材料的前驱体生长分为两个阶段,第一阶段为无定型粒子的快速成核过程; 第二阶段为初级粒子相互团聚结晶过程.
(2)利用TG-DSC手段确定出前驱体的最佳焙烧温度为350℃,在氮气气氛下焙烧3 h时制得Fe3 O4微/纳米材料.
(3)将Fe3 O4微/纳米材料用于对BB209进行降解. 反应时间为30 min时,300℃条件下Fe3 O4微/纳米材料对BB209的降解率几乎达到100%,且具有较好的热稳定性. 对BB209展现出较高的降解活性,其原因可能是由于特殊的哑铃状孔隙片层结构使其具有较大的比表面积,从而表面具有较多活性位点和空位使其降解.
(4)利用GC-MS检测到的哑铃状Fe3 O4微/纳米材料对BB209的降解产物为NoBB到MBB和联苯,说明对BB209在Fe3 O4微/纳米材料表面存在逐级的加氢脱溴路径. 此外,在降解产物中确定出3种NoBB单体BB206、 BB207、 BB208,且3种单体含量的大小顺序为:BB207>BB208>BB206,表明BB209间位上的溴活性最高,最容易脱去,而邻位上的溴最难脱除. BB209在Fe3 O4中的主要加氢脱溴路径为BB209 BB207 OcBB … MBB BB.
| [1] | 马玉. 近海沉积物和食品中多溴联苯醚与多溴联苯的GC-NCI/MS分析方法研究与应用[D]. 厦门: 厦门大学, 2007. 6-7. |
| [2] | 刘春林, 姜朝武, 邵颖, 等. TiO2光催化降解十溴联苯的动力学及机理研究[J]. 武汉大学学报(理学版), 2012, 58 (4): 297-301. |
| [3] | Sjödin A, Wong L Y, Jones R S, et al. Serum concentrations of polybrominated diphenyl ethers (PBDEs) and polybrominated biphenyl (PBB) in the United States population: 2003-2004[J]. Environmental Science & Technology, 2008, 42 (4): 1377-1384. |
| [4] | Daso A P, Fatoki O S, Odendaal J P, et al. Occurrence of polybrominated diphenyl ethers (PBDEs) and 2, 2', 4, 4', 5, 5'-hexabromobiphenyl (BB-153) in water samples from the Diep River, Cape Town, South Africa[J]. Environmental Science and Pollution Research, 2013, 20 (8): 5168-5176. |
| [5] | Benbow A W, Cullis C F. The formation of toxic products during the combustion of halogen-containing polymers[J]. European Polymer Journal, 1975, 11 (10): 723-727. |
| [6] | Wang M S, Chen S J, Lai Y C, et al. Characterization of persistent organic pollutants in ash collected from different facilities of a municipal solid waste incinerator[J]. Aerosol and Air Quality Research, 2010, 10 (4): 391-402. |
| [7] | 牟义军, 周纯, 陈涛, 等. 典型电子废物集中处置场地及其周边土壤中多溴联苯的污染特征[J]. 生态与农村环境学报, 2012, 28 (5): 550-553. |
| [8] | Wei B, Li S H, Lee H K, et al. Complete debromination of polybrominated benzenes at room temperature catalyzed by palladium metallocenyl diphosphine complexes[J]. Journal of Molecular Catalysis A: Chemical, 1997, 126 (2-3): L83-L88. |
| [9] | Wang Y M, Li A, Liu H X, et al. Development of quantitative structure gas chromatographic relative retention time models on seven stationary phases for 209 polybrominated diphenyl ether congeners[J]. Journal of Chromatography A, 2006, 1103 (2): 314-328. |
| [10] | Stapleton H M, Alaee M, Letcher R J, et al. Debromination of the flame retadant decabromodiphenyl ether by juvenile carp(Cyprinus carpio) following dietary exposure[J]. Environmental Science & Technology, 2004, 38 (1): 112-119. |
| [11] | Jia M K, Su G J, Zheng M H, et al. Synthesis of a magnetic micro/nano Fe<em>xO<em>y-CeO2 composite and its application for degradation of hexachlorobenzene[J]. Science China Chemistry, 2010, 53 (6): 1266-1272. |
| [12] | Zacheis G A, Gray K A, Kamat P V. Radiation induced catalytic dechlorination of hexachlorobenzene on oxide surfaces[J]. The Journal of Physical Chemistry B, 2001, 105 (20): 4715-4720. |
| [13] | Zhang L F, Zheng M H, Zhang B, et al. Decomposition of hexachlorobenzene over Al2O3 supported metal oxide catalysts[J]. Journal of Environmental Sciences, 2008, 20 (12): 1523-1526. |
| [14] | Zhang L F, Zheng M H, Liu W B, et al. A method for decomposition of hexachlorobenzene by γ-alumina[J]. Journal of Hazardous Materials, 2008, 150 (3): 831-834. |
| [15] | Lichtenberger J, Amiridis M D. Catalytic oxidation of chlorinated benzenes over V2O5/TiO2 catalysts[J]. Journal of Catalysis, 2004, 223 (2): 296-308. |
| [16] | Zhang L, He R, Gu H C. Synthesis and kinetic shape and size evolution of magnetite nanoparticles[J]. Material Research Bulletin, 2006, 41 (2): 260-267. |
| [17] | Jia M K, Su G J, Zheng M H, et al. Development of self-assembled 3D Fe<em>xO<em>y micro/nano materials for application in hexachlorobenzene degradation[J]. Journal of Nanoscience and Nanotechnology, 2011, 11 (3): 2100-2106. |
| [18] | 方国东, 司友斌. 纳米四氧化三铁对2, 4-D的脱氯降解[J]. 环境科学, 2010, 31 (6): 1499-1505. |
| [19] | Su G J, Lu H J, Zhang L X, et al. Thermal degradation of octachloronaphthalene over as-prepared Fe3O4 micro/nanomaterial and its hypothesized mechanism[J]. Environmental Science & Technology, 2014, 48 (12): 6899-6908. |
| [20] | Huang L Y, Su G J, Zhang A Q, et al. Degradation of polychlorinated biphenyls using mesoporous iron-based spinels[J]. Journal of Hazardous Materials, 2013, 261 : 451-462. |
| [21] | Zhong L S, Hu J S, Liang H P, et al. Self-assembled 3D flowerlike iron oxide nanostructures and their application in water treatment[J]. Advanced Materials, 2006, 18 (18): 2426-2431. |
| [22] | Chakroune N, Viau G, Ammar S, et al. Synthesis, characterization and magnetic properties of disk-shaped particles of a cobalt alkoxide: CoⅡ (C2H4O2)[J]. New Journal of Chemistry, 2005, 29 (2): 355-361. |
| [23] | Jiang X C, Wang Y L, Herricks T, et al. Ethylene glycol-mediated synthesis of metal oxide nanowires[J]. Journal of Materials Chemistry, 2004, 14 (4): 695-703. |
| [24] | Su G J, Liu Y X, Huang L Y, et al. Synthesis of hierarchical Mg-doped Fe3O4 micro/nano materials for the decomposition of hexachlorobenzene[J]. Chemosphere, 2014, 99 : 216-223. |
| [25] | Wang Y L, Jiang X C, Xia Y N. A solution-phase, precursor route to polycrystalline SnO2 nanowires that can be used for gas sensing under ambient conditions[J]. Journal of the American Chemical Society, 2003, 125 (52): 16176-16177. |
| [26] | Goodman A L, Bernard E T, Grassian V H. Spectroscopic study of nitric acid and water adsorption on oxide particles: Enhanced nitric acid uptake kinetics in the presence of absorbed water[J]. The Journal of Physical Chemistry A, 2001, 105 (26): 6443-6457. |
| [27] | Li B J, Li Y Y, ZhaoY B, et al. Shape-controlled synthesis of Cu2O nano/microcrystals and their antibacterial activity[J]. Journal of Physics and Chemistry of Solids, 2013, 74 (12): 1842-1847. |
| [28] | 段明, 刘长坤, 付秀峰. 分散聚合法制备聚丙烯酰胺水分散体[J]. 石油化工, 2007, 36 (10): 1006-1011. |
| [29] | Politi Y, Arad T, Klein E, et al. Sea urchin spine calcite forms via a transient amorphous calcium carbonate phase[J]. Science, 2004, 306 (5699): 1161-1164. |
| [30] | Cölfen H, Mann S. Higher-order organization by mesoscale self-assembly and transformation of hybrid nanostructures[J]. Angewandte Chemie/International Edition, 2003, 42 (21): 2350-2365. |
| [31] | Cao A M, Hu J S, Liang H P, et al. Hierarchically structured cobalt oxide (Co3O4): the morphology control and its potential in sensors[J]. The Journal of Physical Chemistry B, 2006, 110 (32): 15858-15863. |
| [32] | Spalla O, Nabavi M, Minter J, et al. Osmotic compression of mixtures of polymers and particles[J]. Colloid and Polymer Science, 1996, 274 (6): 555-567. |
| [33] | Zhong L S, Hu J S, Cao A M, et al. 3D flowerlike ceria micro/nanocomposite structure and its application for water treatment and CO removal[J]. Chemistry of Materials, 2007, 19 (7): 1648-1655. |
| [34] | 刘琪, 周世伟, 马宣宣, 等. Raney Ni催化4-溴联苯加氢降解研究[J]. 环境科学学报, 2010, 30 (6): 1193-1198. |
| [35] | Chen J Y, Xu T J, Ding J Y, et al. Mn-Ce-Co complex oxide nanoparticles: Hydrothermal synthesis and their catalytic subcritical oxidation of 4, 4'-Dibromobiphenyl[J]. Journal of Hazardous Materials, 2012, 235-236 : 85-91. |
| [36] | Hayashi E, Iwamatsu E, Biswas M E, et al. Characterization of high surface area smectite supported cobalt oxides catalysts for hydrodesulfurization by means of TPR, TPS and ESR[J]. Applied Catalysis A: General, 1999, 179 (1-2): 203-216. |
| [37] | Wang J A, Bokhimi X, Novaro O, et al. Effects of structural defects and acid-basic properties on the activity and selectivity of isopropanol decomposition on nanocrystallite sol-gel alumina catalyst[J]. Journal of Molecular Catalysis A: Chemical, 1999, 137 (1-3): 239-252. |
| [38] | 刘莎, 石瑞芳, 黄学敏, 等. 金属氧化物对十氯联苯的降解研究[J]. 中国科学: 化学, 2014, 44 (10): 1665-1674. |
| [39] | Murena F, Schioppa E. Kinetic analysis of catalytic hydrodechlorination process of polychlorinated biphenyls (PCBs)[J]. Applied Catalysis B: Environmental, 2000, 27 (4): 257-267. |
| [40] | Yamada S, Naito Y, Takada M, et al. Photodegradation of hexachlorobenzene and theoretical prediction of its degradation pathways using quantum chemical calculation[J]. Chemosphere, 2008, 70 (4): 731-736. |
| [41] | 刘国瑞, 李丽, 孙素芳, 等. 多溴联苯的污染来源、 分析方法和环境污染特征[J]. 化学进展, 2014, 26 (8): 1434-1444. |
| [42] | Wu W H, Xu J, Ohnishi R. Complete hydrodechlorination of chlorobenzene and its derivatives over supported nickel catalysts under liquid phase conditions[J]. Applied Catalysis B: Environmental, 2005, 60 (1-2): 129-137. |
| [43] | Lin S J, Su G J, Zheng M H, et al. The degradation of 1, 2, 4-trichlorobenzene using synthesized Co3O4 and the hypothesized mechanism[J]. Journal of Hazardous Materials, 2011, 192 (3): 1697-1704. |
 2016, Vol. 37
2016, Vol. 37


