2. 大连理工大学环境学院, 大连 116024;
3. 麦王环保工程技术有限公司, 上海 200135;
4. 大连理工大学能源与动力学院, 大连 116024
2. School of Environmental Science and Technology, Dalian University of Technology, Dalian 116024, China;
3. McWong Environmental Engineering Co., Ltd., Shanghai 200135, China;
4. School of Energy and Power Engineering, Dalian University of Technology, Dalian 116024, China
结垢问题普遍存在于工业热能动力系统中,影响了循环冷却水系统的正常运行. 外加阻垢剂(如EDTA、 ATMP、 HEDP等)或软化剂(如Na2CO3、 Ca(OH)2等)可缓解结垢现象,但可能会由于引入化学药剂造成水质二次污染等后果[1]. 离子交换吸附软化法是控制水体硬度常用有效的方法之一[2]. 活性树脂等有机材料应用相对较为频繁,但在高温流体环境下稳定性相对较差,容易产生热膨胀变形甚至表面失活等负面作用,故难以用于热能动力系统的水质软化.
斜发沸石是一种含水的碱或碱土金属组成的硅铝酸盐矿物质,它具有晶型骨架结构和规则的表面孔隙[3],其铝氧四面体中不饱和氧原子使得其表面带有负电,由附近带正电的阳离子如K+和Na+等补偿平衡. 在适当反应条件下,沸石骨架中活性阳离子(如Na+)可以迅速和溶液中游离的目标阳离子进行物质交换,且这种交换过程通常是可逆的,这使得沸石作为优良吸附材料在环境水处理领域受到了一定关注[4, 5, 6, 7]. 另一方面,沸石材料通常具有良好的物理强度和热稳定性,且分布广泛价格低廉,适宜在热水环境中应用发挥其表面化学功能实现水体软化,故探索利用天然沸石去除工业热水中的硬度离子具有良好应用前景. 目前国内外就斜发沸石吸附交换去除金属阳离子污染物的研究已有相关报道(包括去除Cu2+[8]、 Cd2+[9]、 Mn2+[10]等),而利用其去除水中硬度离子的研究相对较少[11].
本研究针对工业热水环境特点,通过Na+活化改性天然斜发沸石,研究其对典型结垢离子Ca2+的去除特性,重点探讨反应体系水温变化响应的吸附过程及相关动力学/热力学特征,以期为基于沸石改性技术的工业热水在线实时除硬提供科学参考. 1 材料与方法
1.1 药剂与设备
实验用氯化钙、 氯化钠等药品均从天津科密欧化学试剂有限公司购买(纯度:分析纯). 溶液采用去离子水配置而成.
反应水温采用HH-S型精密恒温水浴精确控制(精度可达±0.02℃). 溶液pH采用Cyber Scan PH1500型pH计在线测定. 斜发沸石的比表面积、 孔容积、 孔径等结构参数均采用美国康塔仪器公司Autosorb-1型物理吸附仪进行测定. 使用XRF-1800型X射线荧光光谱仪对斜发沸石主要成分进行识别与定量. 采用Bruker-Vector傅里叶变换红外光谱仪(FT-IR)对斜发沸石改性前后的红外骨架特征进行检测.
1.2 实验原料及活化处理
天然斜发沸石样品由辽宁葫芦岛康华科技提供. 斜发沸石经研磨筛分后粒径控制在0.5~1 mm,配置15%NaCl溶液,将颗粒与溶液按1 ∶2.5体积比例混合并加热煮沸30 min,用去离子水冲洗颗粒至无悬浮粉末后烘干,即完成一次活化. 根据活化次数将固体样品命名为HX-n(n=1,2,3…). Na+活化前后斜发沸石组织结构参数和成分含量变化情况见表 1.
常规吸附实验:在预定温度下,将1 g活化斜发沸石加入到50 mL已知质量浓度CaCl2溶液中,控制在恒温水浴环境下反应1 h后测溶液Ca2+浓度,并分别考察水温、 pH及吸附剂量等影响因素.
动力学实验:在不同温度下开展(即30、 50和70℃),将1 g活化斜发沸石添加至50 mL含Ca2+溶液中(初始Ca2+浓度为400 mg ·L-1),定时测取Ca2+浓度至吸附平衡.
热力学实验:在不同温度和不同初始Ca2+浓度下完成.
再生吸附性能实验:在30℃水温条件下,将1 g活化斜发沸石样品添加至不同初始浓度Ca2+溶液中,达到吸附平衡时记录吸附率并经相同活化方法再生后重复进行实验.
吸附量(q,mg ·g-1)和吸附率(x,%)分别根据方程(1)和(2)计算得出:
实验采用离子选择性电极法在线测定溶液中Ca2+时变浓度. 将电极联机后插入溶液,通过计算机读取响应电位值. 配制Ca2+标准溶液(浓度范围介于0~8 g ·L-1),绘制标准溶液电位对数值与体相Ca2+浓度对应的标准曲线,结合待测溶液电位值确定Ca2+浓度.
2 结果与讨论
2.1 斜发沸石Na+活化与Ca2+吸附性能研究
天然斜发沸石骨架结构中通常会存在一定量的钙离子,因此需要对其进行离子活化增强颗粒表面的活性点位以便优化其除硬能力. 根据工厂实际的活化条件,本研究采用固/液体积比1 ∶2.5加入15% NaCl母液煮沸活化. 图 1为不同活化次数的斜发沸石在50℃含Ca2+溶液中反应1 h所对应的钙离子吸附去除情况. 未经活化的斜发沸石由于其自身结构中Ca2+含量高,可供交换的Na+、 K+等主要活性点位相对有限,使得其吸附去除Ca2+能力受到限制,对应的钙离子吸附率仅为8%(见图 1). 经过Na+化学活化可有效提升沸石活性,1次活化对应Ca2+吸附率提高至11%,经第2次、 第3次活化其处理硬水能力成倍提高,且3次活化使得钙离子吸附率高达44%. XRF分析结果表明,3次活化后斜发沸石CaO含量从6.2%(未活化)降至0.94%,而Na2O含量从0.7%(未活化)升至7.23%,由此可推测经过活化斜发沸石骨架上Ca2+大部分被活泼的Na+取代,导致颗粒对水体中游离Ca2+吸附/离子交换能力迅速提升. 另外如表 1所示,经3次Na+活化斜发沸石的比表面积、 孔容积等物理结构参数均有所提升,这说明热活化过程可适当改善和优化沸石表面的微孔孔道结构,这对吸附去除目标离子具有积极意义. 若继续增加Na+活化次数(>3次),样品对钙离子吸附率无明显提升甚至略有降低,这可能由于多次高温活化导致沸石骨架结构略有坍塌,造成吸附效率降低. 故本实验斜发沸石活化次数控制在3次为宜.
对改性前后的斜发沸石的FT-IR对比表征结果如图 2所示,结果表明经3次热水活化的斜发沸石特征红外骨架依然保持相对完整[12,13],同时沸石骨架上的其他无机离子及其含量变化(如Na+)未见出现特征红外波谷.
经过3次活化的斜发沸石样品(标记为HX-3)在不同温度下的吸附平衡动力学曲线如图 3所示. 在反应初始5 h内颗粒的吸附速率增长较快,对Ca2+吸附量随反应时间迅速增加,反应约20 h接近吸附平衡. 可以观察到温度越高,体系达到吸附平衡的时间相对缩短,表明除硬效率有所提升. 可见工业高温热水环境客观上会加速活化斜发沸石的除硬过程,尽管从图 3可以看到温度变化对改性沸石的Ca2+平衡吸附量几乎没有明显改变.
采用二级吸附动力学模型对实验数据进行拟合检验,其中二级模型微分方程如下:
对HX-3样品在不同温度下吸附钙离子动力学拟合结果见表 2. 结果表明,活化斜发沸石HX-3对钙离子吸附与二级动力学过程吻合度较高,说明该过程符合单分子层吸附机制[14],满足基于单分子层吸附机制推导的吸附动力学方程. k2随温度升高而增大,表明热水环境有利于提升Ca2+吸附反应速率.
根据所得到的速率常数可计算吸附过程活化能,如方程(4)所示:
根据活化能数值能够判断吸附反应主要是物理吸附还是化学吸附,其中物理吸附过程对应活化能通常在5~40 kJ ·mol-1,而化学吸附对应的活化能区间相对较高(40~800 kJ ·mol-1[15]). 相比单纯扩散吸附过程,动力学吸附(以电子转移或共用电子对为特征)所对应的活化能通常大于25~30 kJ ·mol-1[16]. 在方程(4)基础上对lnk2和
图 4为不同温度下活化斜发沸石HX-3处理不同浓度Ca2+的吸附平衡曲线.
分别采用Langmuir方程(5)和Freundlich方程(6)吸附等温过程对实验数据进行拟合,并进行线性回归计算,结果见表 3.
根据表 3结果对比,Langmuir方程相比 Freundlich方程可以更好地描述本实验条件下的吸附等温过程(R2>0.996). 根据Langmuir等温式可进一步推算各温度下活化斜发沸石对钙离子的最大吸附量,其中343.15 K热水环境中(即70℃)对应颗粒的最大吸附量为60.976 mg ·g-1. 数据显示温度升高,最大吸附量上升幅度较小,故在工业热水系统中可根据该特征,用低温下活化斜发沸石对硬度离子(如Ca2+)的最大吸附量判断高温环境时填料是否吸附饱和,以便在恰当的时候更换吸附剂.
Langmuir方程可用无量纲常量——分离因子(RL)预测吸附剂与吸附质之间的结合力,计算如下[17]:
基于方程(7)可计算活化斜发沸石HX-3对游离Ca2+吸附的RL值,结果如图 5所示. 根据该评判准则,30~70℃实验溶液环境下RL均小于1,说明活化斜发沸石HX-3对Ca2+吸附有利. 从图 5中可以观察到提高溶液温度和初始Ca2+浓度均有利于吸附,可以推测出工业热水系统在线高温流体环境下使用活化斜发沸石除硬是适合的.
吸附过程焓变(ΔH)和熵变(ΔS)可通过范特霍夫(Vant Hoff)方程(8)计算[18],不同温度下的吸附吉布斯自由能(ΔG)通过方程(9)计算:
结果见表 4,数据中ΔH为正值说明活化斜发沸石HX-3吸附钙离子为吸热反应,ΔS大于0证实了熵增吸附特性,ΔG小于0说明反应体系为自发进 行. ΔG随温度升高而逐渐减小,说明升高水体温度 有利于斜发沸石吸附除硬.
2.4 不同温度下溶液pH对活化斜发沸石吸附效果影响
本研究通过调节溶液pH值(盐酸和氢氧化钠)考察活化斜发沸石HX-3对钙离子吸附效果(初始Ca2+浓度400 mg ·L-1),结果如图 6所示.
如图 6所示,不同温度条件下随着pH升高总吸附量均增加. 在pH值在2~4时吸附量随pH值增长较快; pH值在接近中性(5~8)时吸附量变化不明显; pH值在9~12时吸附量随pH值增长而继续略有增加. 酸性条件下,颗粒对Ca2+吸附能力较低,分析原因可能是溶液中H+相对较多时会与Ca2+形成吸附竞争,使得Ca2+吸附量下降. 在碱性条件下吸附效果轻微提升的原因可能是周边游离Na+离子促成了斜发沸石表面一些点位的进一步活化改性,使其与Ca2+的可交换度增大而导致吸附量有所提高. 总体来说提高pH有利于斜发沸石吸附除硬. 需要注意的是,在实验对应的Ca2+浓度条件下,当pH>12时热水反应体系中会出现絮状Ca(OH)2沉淀,易堵塞斜发沸石孔径,降低材料吸附性能及使用周期,故应考虑避免. 根据实验结果建议活化斜发沸石工业热水除硬溶液pH控制在6~10之间.
2.5 固液比对活化斜发沸石吸附效果的影响
表 5记录了活化斜发沸石投加剂量对Ca2+吸附影响. 结果表明固/液比增大可提升有效吸附/离子交换“点位”而促进对目标硬度离子的吸附去除. 然而投入颗粒剂量加大会降低单位质量的活化斜发沸石对Ca2+的吸附去除能力(溶液初始Ca2+浓度一定),且在不同热水温度下均可观察到此规律. 工业热水系统可根据此特点,需要结合实际硬度离子浓度情况,理性控制吸附剂投加量,以达到合理控制吸附除硬效率的目的.
采用15%NaCl溶液按照固/液体积比1 ∶2.5混合并加热煮沸30 min对吸附饱和的活化斜发沸石HX-3进行化学再生,并将再生样品循环用于处理不同钙离子浓度的水样.
结果如图 7所示,初始Ca2+浓度小于20 mg ·L-1时,HX-3样品可在保持最大吸附能力前提下最少循环使用9次(吸附量无明显下降); 初始Ca2+浓度在20~200 mg ·L-1时,HX-3样品仍可在保持最大吸附能力前提下最少循环使用6次; 而当初始Ca2+浓度高达400 mg ·L-1时,样品循环使用5次后对于Ca2+的吸附能力开始显著下降. 实验结果表明将活化斜发沸石用于工业热水除硬时,可根据待处理水体的硬度离子浓度理性确定吸附剂的循环使用次数. 对于和本实验体系相似的情况,在初始Ca2+浓度小于20 mg ·L-1时,活化斜发沸石可至少有效循环使用9次.
3 结论
针对工业热水除硬,尝试开展了通过钠离子活化斜发沸石吸附典型硬度Ca2+离子实验. 结果表明热水温度体系有利于斜发沸石吸附Ca2+(70℃时对应的最大吸附量为60.98 mg ·g-1),尽管温度升高对最大吸附量的影响相对较小. 对吸附过程的动力学和热力学特性进行了研究解析,并确定该反应体系为自发、 吸热的化学吸附过程. 此外,需要结合实际硬度离子浓度情况,理性控制吸附剂投加量和溶液pH(控制在6~10之间为宜). 本研究用到的活化斜发沸石在处理初始钙离子浓度低于400 mg ·L-1的工业废水时至少可有效再生使用5次. 实验证明活化斜发沸石在30~70℃热水环境中对Ca2+有较强吸附能力,适合工业热水系统在线高温环境下除硬. ![]()
表 1 Na+活化前后斜发沸石相关物化参数
Table 1 physicochemical properties of clinoptilolite before and after Na+-activation
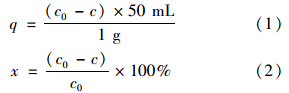
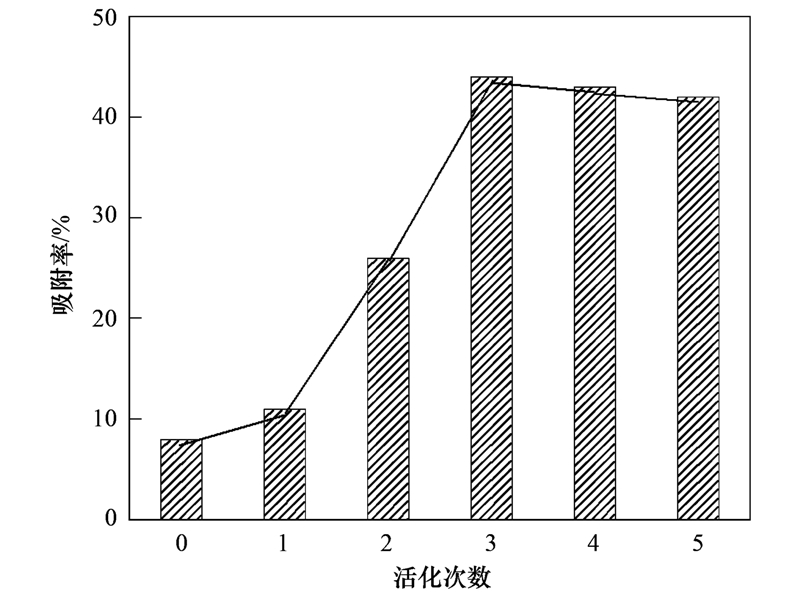
颗粒投加量:1 g; 初始Ca2+浓度:400 mg ·L-1
图 1 活化次数对Ca2+吸附率变化
Fig. 1 Activation time vs. Ca2+adsorption rate
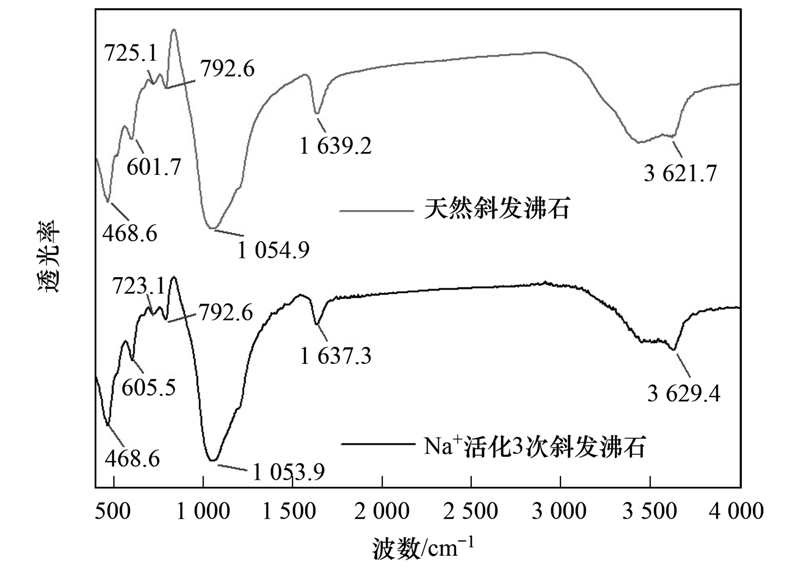
图 2 活化前后FT-IR谱图
Fig. 2 FT-IR spectra of clinoptilolite before and after Na+-activation
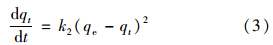
![]()
表 2 不同温度下的二级吸附动力学常数
Table 2 Pseudo-second order kinetic constants
obtained under different solution temperature
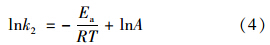
 做曲线即可推算出Ea. 本实验体系活化能Ea计算结果为41.89 kJ ·mol-1,可判断出对Ca2+吸附过程属于低能垒化学吸附且符合动力学吸附规律(kinetic sorption).
做曲线即可推算出Ea. 本实验体系活化能Ea计算结果为41.89 kJ ·mol-1,可判断出对Ca2+吸附过程属于低能垒化学吸附且符合动力学吸附规律(kinetic sorption).
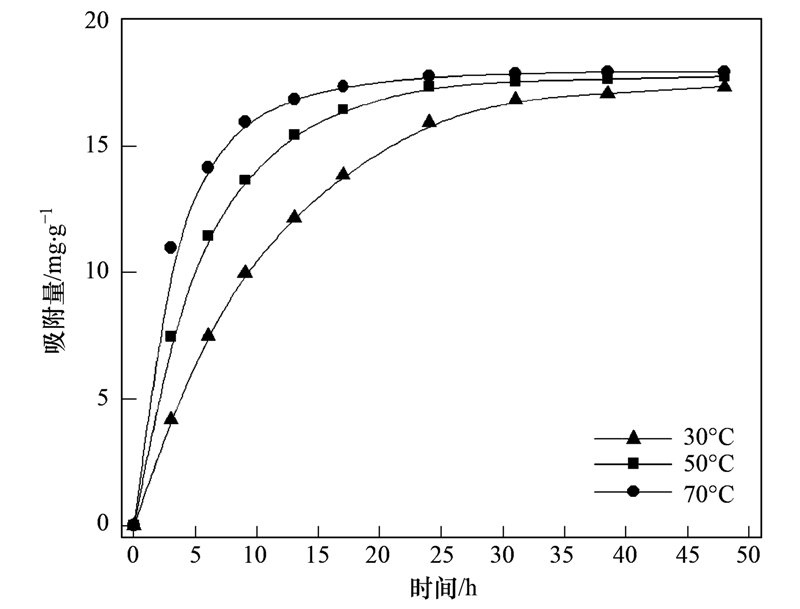
图 3 不同温度下活化斜发沸石对Ca2+吸附平衡动力学曲线
Fig. 3 Adsorption kinetic curve of Ca2+ by activated clinoptilolite under different temperatures
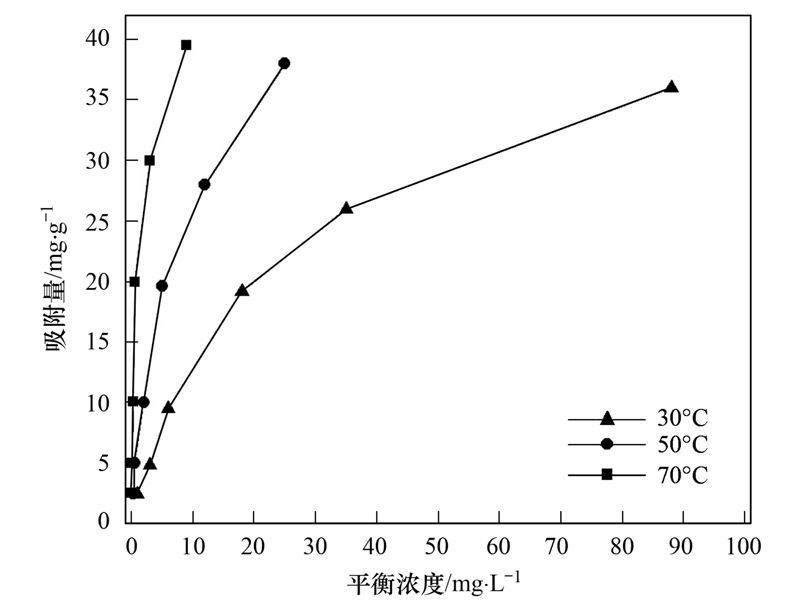
图 4 不同温度下活化斜发沸石对Ca2+吸附等温线
Fig. 4 Adsorption isotherm of Ca2+by activated clinoptilolite under different temperatures
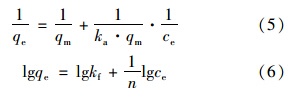
![]()
表 3 不同温度下活化斜发沸石吸附Ca2+等温参数
Table 3 Adsorption isotherms of Ca2+ by activated clinoptilolite under different temperature
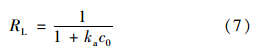
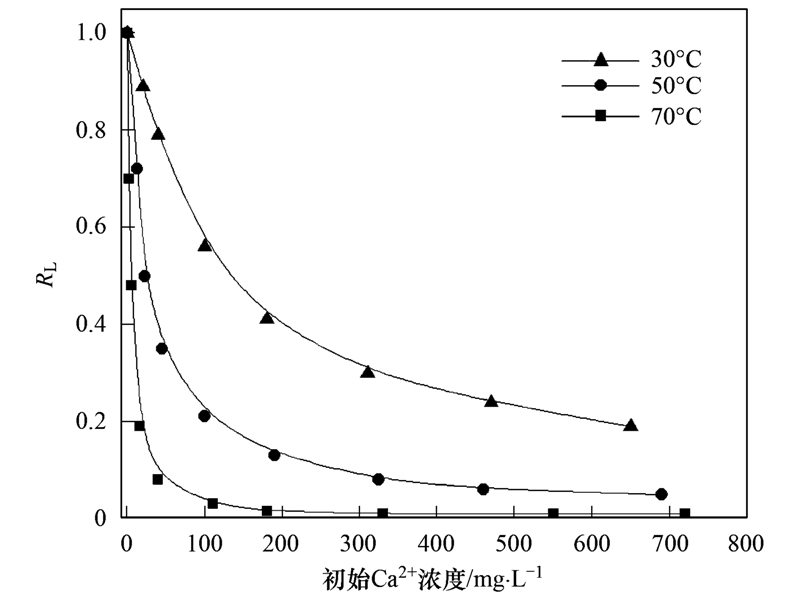
图 5 不同温度下分离因子(RL)与初始Ca2+浓度关系曲线
Fig. 5 Separation factor (RL) vs. initial concentration
of Ca2+ under different temperatures
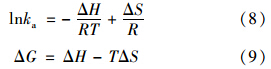
![]()
表 4 活化斜发沸石吸附Ca2+热力学参数
Table 4 Thermodynamic parameters for adsorption of Ca2+ by activated clinoptilolite
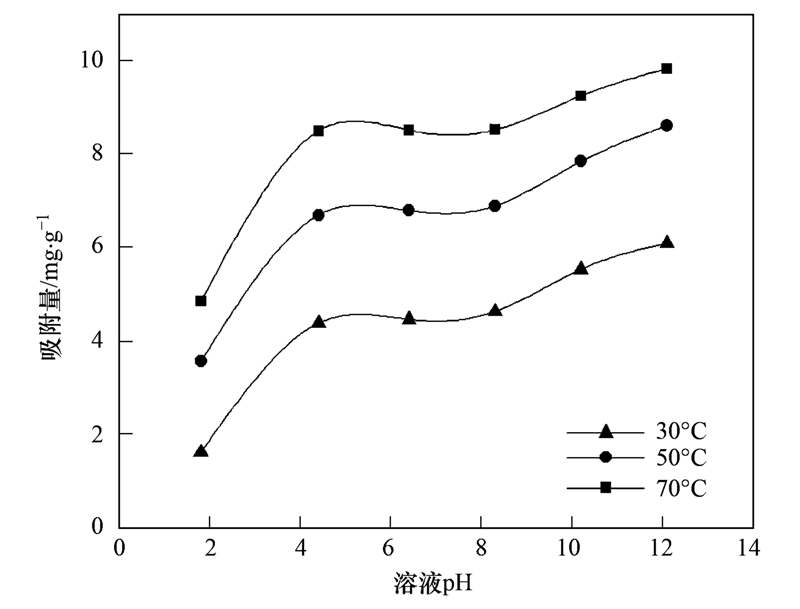
图 6 不同温度下溶液pH对活化斜发沸石HX-3吸附Ca2+影响
Fig. 6 Effects of pH on adsorption capacity of Ca2+by HX-3 clinoptilolite under different temperatures
![]()
表 5 HX-3样品用量对Ca2+吸附影响
Table 5 Dosage effect of HX-3 on adsorption of Ca2+
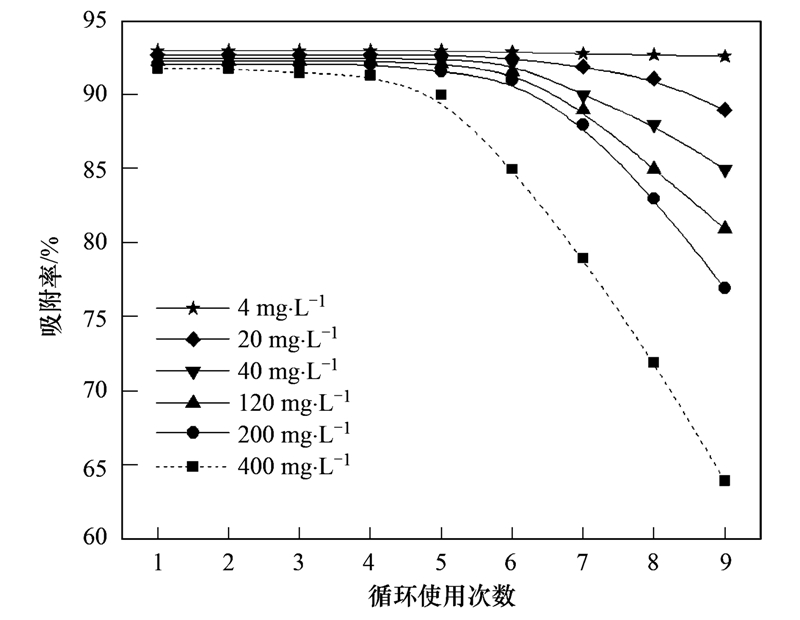
图 7 活化斜发沸石HX-3再生循环吸附去除Ca2+
Fig. 7 EffectsAdsorptive removal of Ca2+ by regenerated HX-3 clinoptilolite
| [1] | 胡百顺, 郭学辉, 王康, 等. 绿色缓蚀阻垢剂的研究及应用进展[J]. 工业水处理, 2013, 33 (5): 9-12. |
| [2] | Pakzadeh B, Batista J R. Chromium removal from ion-exchange waste brines with calcium polysulfide[J]. Water Research, 2011, 45 (10): 3055-3064. |
| [3] | Ali O, Leili R. Influence of natural clinoptilolite nanoparticles on thermal stability, scratch resistance and adherence properties of Acrylonitrile butadiene styrene (ABS)[J]. Fibers and Polymers, 2013, 14 (3): 447-452. |
| [4] | 黎园, 赵纯, 邓慧萍. 2种孔径沸石分子筛对水中土霉素的去除研究[J]. 环境科学, 2010, 31 (4): 990-995. |
| [5] | 王家德, 郑亮巍, 朱润晔, 等. 改性13X沸石蜂窝转轮对甲苯的吸附性能研究[J]. 环境科学, 2013, 34 (12): 4684-4688. |
| [6] | 李佳, 林建伟, 詹艳慧, 等. 溴化十六烷基吡啶改性沸石对水中菲的吸附作用[J]. 环境科学, 2014, 35 (2): 611-618. |
| [7] | 张新颖, 吴志超, 王志伟, 等. 天然斜发沸石粉对溶液中NH4+的吸附机理研究[J]. 中国环境科学, 2010, 30 (5): 609-614. |
| [8] | Abdulkareem S A, Muzenda E, Afolabi A S, et al. Treatment of clinoptilolite as an adsorbent for the removal of copper ion from synthetic wastewater solution[J]. Arabian Journal for Science and Engineering, 2013, 38 (9): 2263-2272. |
| [9] | Ahmed I A M, Young S D, Crout N M J. Ageing and structural effects on the sorption characteristics of Cd2+ by clinoptiloliteand Y-type zeolite studied using isotope exchange technique[J]. Journal of Hazardous Materials, 2010, 184 (1-3): 574-584. |
| [10] | Doula M K. Removal of Mn2+ ions from drinking water by using clinoptilolite and a clinoptilolite-Fe oxide system[J]. Water Research, 2006, 40 (17): 3167-3176. |
| [11] | Yusof A M, Malek N A N N, Kamaruzaman N A, et al. Removal of Ca2+ and Zn2+ from aqueous solutions by zeolites NaP and KP[J]. Environmental Technology, 2010, 31 (1): 41-46. |
| [12] | Mozgawa W, Król M, Pichór W. Use of clinoptilolite for the immobilization of heavy metal ions and preparation of autoclaved building composites[J]. Journal of Hazardous Materials, 2009, 168 (2-3): 1482-1489. |
| [13] | Mozgawa W, Król M, Bajda T. Application of IR spectra in the studies of heavy metal cations immobilization on natural sorbents[J]. Journal of Molecular Structure, 2009, 924-926 (30): 427-433. |
| [14] | Eunice F S V, Antonio R C, Elias de B S, et al. Interaction of Ag(Ⅰ), Hg(Ⅱ), and Cu(Ⅱ) with 1,2-ethanedithiol immobilized on chitosan: Thermochemical data from isothermal calorimetry[J]. Journal of Colloid and Interface Science, 2005, 289 (1): 42-47. |
| [15] | Hendrik N, Murielle R, Pierre L, et al. Removal of PCBs from wastewater using fly ash[J]. Chemosphere, 2003, 53 (6): 655-665. |
| [16] | Ho Y S, Ng J C Y, McKay G. Kinetics of pollutant sorption by biosorbents: Review[J]. Separation and Purification Methods, 2000, 29 (2): 189-232. |
| [17] | Abu Al-Rub F A, El-Naas M H, Benyahia F, et al. Biosorption of nickel on blank alginate beads, free and immobilized algal cells[J]. Process Biochemistry, 2004, 39 (11): 1767-1773. |
| [18] | Ahmed M D, Asem A A, El-Boraey H A, et al. Adsorption of Ag(Ⅰ) on glycidyl methacrylate/N,N'-methylene bis-acrylamide chelating resins with embedded iron oxide[J]. Separation and Purification Technology, 2006, 48 (3): 281-287. |
 2015, Vol. 36
2015, Vol. 36

