AOB和ANAMMOX菌是两种自养微生物菌群, 具有稳定的协同作用关系[1].结合这两类微生物的优势, 在缺氧条件下无需外加有机碳源和亚硝酸盐即可高效处理高氨氮废水, PN/A技术即利用了该协同作用[2].但ANAMMOX菌生长缓慢、易受基质以及环境条件影响、抗冲击负荷能力差, 使得如何保持PN/A工艺的稳定性成为难点[3, 4].
有研究表明, 微生物包埋技术可选择性将筛选出的优势菌种加以固定, 微生物存在环境较稳定、抗冲击负荷强, 有利于保留世代周期长的ANAMMOX菌[5, 6].陈光辉等[7]采用水性聚氨酯(WPU)对ANAMMOX污泥进行包埋, 有效增加了生物活性和机械稳定性. Ali等[8]以3%的聚乙烯醇(PVA)和1%的海藻酸钠(SA)作为载体, 经过35 d成功启动了ANAMMOX反应器.
本文结合PN/A技术与微生物包埋技术, 以SA为载体, 将AOB和ANAMMOX菌分别进行包埋驯化后搭建PN/A双菌层系统, 考察进水NH4+-N质量浓度和DO对PN/A双菌层工艺稳定性的影响, 以期为PN/A技术的工程应用提供理论基础.
1 材料与方法 1.1 实验装置 1.1.1 AOB污泥驯化装置AOB污泥通过SBR驯化, SBR装置由有机玻璃制成, 总体积为5.0 L.整个驯化过程在室温下进行, pH为7.5±0.5, 通过时间继电器和气体流量计控制DO在1.0~3.0 mg·L-1.
1.1.2 ANAMMOX污泥驯化装置ANAMMOX污泥通过MBR驯化.装置主体由不锈钢制成, 呈圆柱体, 内径12.0 cm, 高25.0 cm, 有效容积2.5 L, 驯化过程密闭、避光.通过磁力搅拌器(RCT basic, IKA, Japan)对反应器进行加热和搅拌, 维持反应器的温度在(35±1)℃, 同时使反应器中的ANAMMOX菌保持悬浮状态.
1.1.3 PN/A双菌层系统实验装置PN/A双菌层系统实验装置如图 1所示.反应器主体由有机玻璃制成, 内部是PN/A反应区, 反应器有效容积为1.5 L; 外部配有水浴层, 控制反应系统温度为(35±1)℃, 底部设有磁力搅拌装置.反应器用铝箔纸包裹, 避光运行.曝气系统由气体流量计、空气泵、多孔曝气管以及装有高纯氮气的氮气瓶组成, 其中空气泵和氮气瓶单独使用, 并通过气体流量计控制DO.反应器内部设有多孔圆盘支架, 用来放置凝胶双菌层.
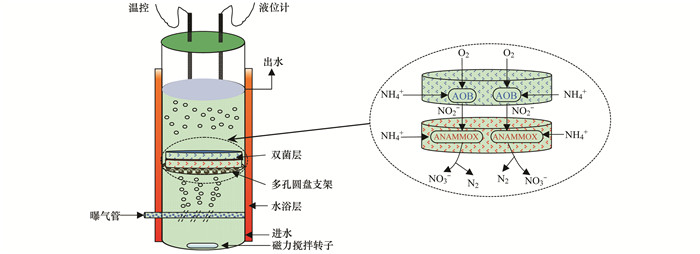
|
图 1 PN/A双菌层系统实验装置示意 Fig. 1 Schematic diagram of the PN/A double-bacteria-layer experimental system |
AOB种泥取自上海市某污水厂, 接种后初始污泥质量浓度(MLVSS)为1.2 g·L-1.污泥驯化过程中, SBR水力停留时间(HRT)为1 d, 污泥龄(SRT)为7 d.驯化开始后, 对反应器中的悬浮液每隔24 h取样分析.
ANAMMOX种泥取自哈工大某实验室运行良好的UASB反应器, 接种后初始污泥MLVSS为1.2 g·L-1.污泥驯化过程中, MBR连续流运行, HRT为2 d, SRT为60 d.驯化开始后, 对反应器中的悬浮液每隔12 h取样分析.
SBR和MBR进水均采用人工配水, 两者的主要成分组成见表 1, 进水pH控制在8.0±0.1. MBR配水中的微量元素Ⅰ、微量元素Ⅱ参照文献[9]的配方.
|
|
表 1 人工模拟废水成分组成 Table 1 Composition of synthetic wastewater |
1.3 驯化污泥的包埋
AOB驯化污泥的包埋方法如下:取20.0 mL 6% SA溶液与已驯化完成的20.0 mL AOB污泥均匀混合, 倒入内径约为100 mm的培养皿固定4 h, 形成直径为100 mm, 厚为4 mm的AOB凝胶层.ANAMMOX驯化污泥的包埋方法与AOB驯化污泥相同, 形成ANAMMOX凝胶层.
1.4 PN/A双菌层反应器的构建与调控运行经1.3节的包埋后, 将AOB凝胶层与ANAMMOX凝胶层叠加, 构建双菌层.本实验中, 双菌层反应器内设有一组双菌层, 双菌层包埋AOB驯化污泥、ANAMMOX驯化污泥各24.0 mg, 实验过程中对双菌层不进行更换.
双菌层反应器进水为人工配水, NH4+-N按需添加, 不加NO2--N, 其余成分与ANAMMOX菌驯化模拟废水一致.反应器连续流运行, 温度控制在(35±1)℃, HRT为1 d, SRT为60 d.
为了探究PN/A双菌层反应器的脱氮性能, 首先进行短期脱氮性能实验.短期实验溶解氧设为0.5 mg·L-1, NH4+-N质量浓度设为120 mg·L-1.在短期实验达到稳定效果之后, 对双菌层进行长期实验研究.为对比包埋效果, 长期实验另设有一对照组, 对照组初始AOB驯化污泥、ANAMMOX驯化污泥含量与双菌层组相同, 但污泥在反应器中呈悬浮态, 其余条件不变.
长期实验分为4个阶段:第一阶段(1~14 d)为低负荷低溶解氧运行阶段, 溶解氧设为0.5 mg·L-1, NH4+-N质量浓度设为60 mg·L-1; 第二阶段(15~32 d)为中负荷中溶解氧运行阶段, 溶解氧设为1.0 mg·L-1, NH4+-N质量浓度设为200 mg·L-1; 第三阶段(33~63 d)为高负荷中溶解氧运行阶段, 溶解氧设为1.0 mg·L-1, NH4+-N质量浓度设为400 mg·L-1; 第四阶段(64~93 d)为高负荷高溶解氧运行阶段, 溶解氧设为3.0 mg·L-1, NH4+-N质量浓度设为400 mg·L-1.
1.5 分析项目与方法水质测试方法:NH4+-N利用纳氏试剂分光光度法测定; NO2--N利用N-(1-萘基)-乙二胺比色法测定; NO3--N利用离子色谱法(ICS-1000, DIONEX)测定; COD通过快速密闭催化消解法(HACH DRB 200, HACH DR2800)测定; TOC利用总有机碳分析仪(TOC-LCPH, SHIMAZU)测定; MLVSS利用重量法测定; pH采用HACH PHC101电极测定; DO采用HACH LDO101电极测定.
微生物样品委托生工生物工程(上海)股份有限公司进行高通量宏基因组微生物测序.
NRR(以MLVSS计)与NLR计算式[10]为:
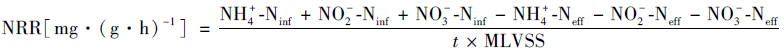
|
(1) |

|
(2) |
上式中, NH4+-Ninf、NO2--Ninf、NO3--Ninf是进水中三类氮元素的质量浓度(mg·L-1), NH4+-Neff、NO2--Neff、NO3--Neff是出水中三类氮元素的质量浓度(mg·L-1), t为HRT(h), 污泥质量浓度MLVSS单位为g·L-1, Vinf为一个HRT期间的进水体积(m3), V为反应器有效容积(m3).
2 结果与讨论 2.1 AOB污泥驯化实验AOB污泥接种至SBR后, 向反应器中投加NH4+-N, NH4+-N初始质量浓度为120 mg·L-1, NO2--N和NO3--N的初始质量浓度为0.如图 2(a)所示, 驯化期间, NH4+-N不断被消耗, 14 d后NH4+-N质量浓度基本为0, NO2--N质量浓度先不断升高, 第10 d到达最大, 随后逐渐降低并稳定在22 mg·L-1; NO3--N质量浓度在前10 d缓慢增长, 而后可能是由于反应器内NO2--N已经积累了较高的浓度, NO3--N增长速率明显变快.
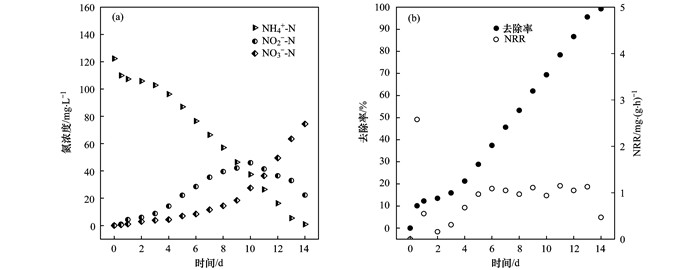
|
图 2 AOB驯化过程中氮浓度、NH4+-N去除率及去除负荷的变化情况 Fig. 2 Nitrogen concentration, shift in ammonium removal rate, and removal load rate in the AOB reactor |
由图 2(b)可知, 反应器初期处理效果不稳定, 经过5 d的适应期后, NH4+-N的NRR基本稳定在1.0 mg·(g·h)-1, 而NH4+-N的去除率持续上升, 最终达到99.0%.
AOB污泥驯化14 d后, 装置中主要微生物在属水平的群落结构如图 3(a)所示.属于AOB的亚硝化单胞菌属(Nitrosomonas, 22.70%)[11], 已成为反应器内的优势菌种.木洞菌属(Woodsholea, 16.71%)[12]相对丰度也较高, 该菌为化能异养菌, 好氧、不具备脱氮功能.值得注意的是, 反应器中也存在同时具有亚硝化与硝化作用的亚硝化螺菌属(Nitrospira, 1.10%)[13]、具有反硝化作用的固氮螺菌属(Azospira, 6.53%)[14]等脱氮功能菌.具有硝化作用的亚硝化螺菌属等的存在, 也为驯化后期NO3--N的积累做出了解释.
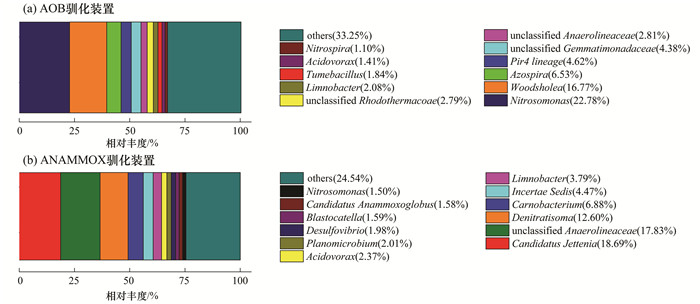
|
图 3 AOB和ANAMMOX驯化装置中微生物的相对丰度 Fig. 3 Bacterial relative abundance of AOB and ANAMMOX enrichment reactors at the genus level |
ANAMMOX污泥接种至MBR反应器中后, 向反应器中投加NH4+-N和NO2--N作为基质, NH4+-N、NO2--N初始质量浓度分别为120 mg·L-1和145 mg·L-1, NO3--N初始质量浓度为0.如图 4所示, 经过12 d的运行, 反应器中的NH4+-N和NO2--N去除率都达到99%以上, 两者的NRR分别约为1.2 mg·(g·h)-1和1.4 mg·(g·h)-1.总体而言, NH4+-N去除率、NO2--N去除率及NRR三者表现出了一致性, 厌氧氨氧化反应成功启动.
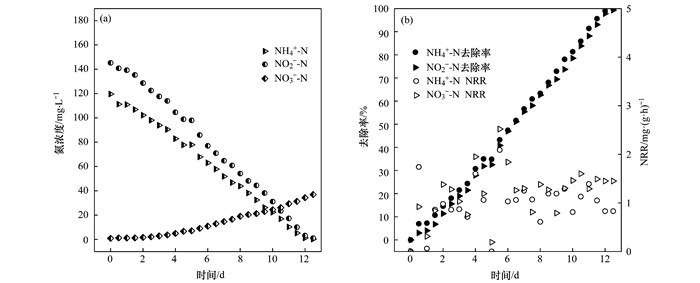
|
图 4 ANAMMOX驯化过程中氮浓度和NH4+-N去除率及去除负荷的变化情况 Fig. 4 Nitrogen concentration and the shifts in ammonium removal rate and removal load rate in the ANAMMOX reactor |
如式(3)所示, ANAMMOX反应NO2--N/NH4+-N理论摩尔比为1.32[15], NO3--N/NH4+-N理论摩尔比为0.26.驯化过程中, NO2--N/NH4+-N约为1.20, 略低于理论值; NO3--N/NH4+-N约为0.31, 略高于理论值.这可能是由于污泥中存在部分AOB和硝化菌(nitrite oxidizing bacteria, NOB)[16, 17].
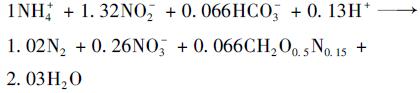
|
(3) |
ANAMMOX污泥驯化12 d后, 装置中主要微生物在属水平的群落结构如图 3(b)所示.污泥中优势菌群分别为Candidatus Jettenia(18.69%)、unclassified Anaerolineaceae(17.83%)以及Denitratisoma(12.60%).其中, Candidatus Jettenia属于厌氧氨氧化菌属[18], 反应器中还存在少量同为厌氧氨氧化菌属的Candidatus Anammoxoglobus(1.58%)[19]; Denitratisoma属于反硝化菌属, 能够将NO3--N还原为NO2--N甚至N2[20]; unclassified Anaerolineaceae属于厌氧绳菌属, 是一类在厌氧反应器中广泛存在的厌氧菌, 能够对有机物进行一定程度的降解[21, 22].此外, 反应器中还存在少量的AOB(Nitrosomonas, 1.50%).多种脱氮功能菌的存在, 使得反应器中的脱氮途径更为复杂, 这可能是导致实验过程中NO2--N、NO3--N、NH4+-N比例与理论值有差异的原因.
2.3 PN/A双菌层系统短期脱氮性能分析PN/A双菌层系统中, 进水中的NH4+-N和环境中的O2经过传质过程进入AOB凝胶层, 载体中的AOB利用O2将NH4+-N部分亚硝化为NO2--N, 从而为下层的ANAMMOX菌的生存提供了厌氧环境. ANAMMOX菌以剩余的NH4+-N为电子供体, 亚硝化产生的NO2--N为电子受体进行ANAMMOX反应.
如图 5所示, 短期实验溶解氧为0.5 mg·L-1, NH4+-N质量浓度为120 mg·L-1.根据NO2--N质量浓度的变化趋势, 可分为第一阶段(1~6 d)、第二阶段(7~10 d)、第三阶段(11~14 d)共3个阶段.第一阶段, NH4+-N不断消耗, NO2--N不断累积, 表明此阶段起主导作用的是AOB; 第二阶段, 由于NO2--N已有一定积累, ANAMMOX反应具有充足的电子受体, ANAMMOX反应逐渐增强, NO2--N开始减少, 该阶段ANAMMOX菌占主导作用; 第三阶段, NO2--N已被大幅消耗, ANAMMOX反应受到限制, 亚硝化作用再次占据主导, NO2--N在出现小幅升高后最终被完全消耗, 3个阶段后NH4+-N去除率达98.8%.
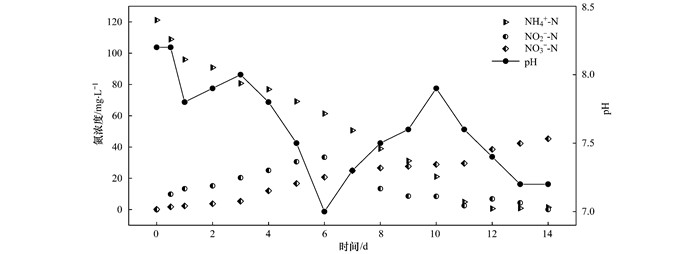
|
图 5 PN/A双菌层体系短期实验氮素和pH变化情况 Fig. 5 Variation of nitrogen and pH in the PN/A double-bacteria-layer system for the short-term experiment |
短期实验中pH在前6 d总体呈下降趋势, 在7~10 d逐渐上升, 而后再次下降并稳定在7.2.而亚硝化反应产酸, 厌氧氨氧化反应产碱[23], pH的变化趋势与3个阶段中氮素的去除规律相一致.
通过短期实验发现, PN/A双菌层系统中脱氮功能菌群具有良好的活性, AOB和ANAMMOX菌在不同阶段分别起主导作用, 最终NH4+-N的去除率高达98.8%, 并维持系统的酸碱平衡.
2.4 PN/A双菌层系统长期脱氮性能分析如图 6和图 7所示, 长期实验划分为4个阶段.第一阶段(1~14 d)为低负荷低溶解氧运行阶段, 溶解氧为0.5 mg·L-1, NH4+-N质量浓度为60 mg·L-1.本阶段结束时, 对照组总氮去除率为67.5%, 而双菌层组总氮去除率达83.6%.
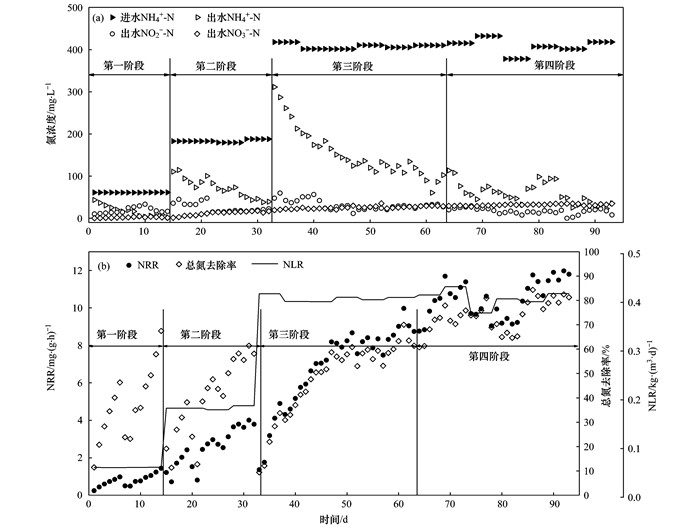
|
图 6 长期实验对照组氮浓度、NRR、NLR及总氮去除率的变化情况 Fig. 6 Nitrogen concentration, NRR, NLR, and the shift in nitrogen removal rate for the control group of the long-term experiment |
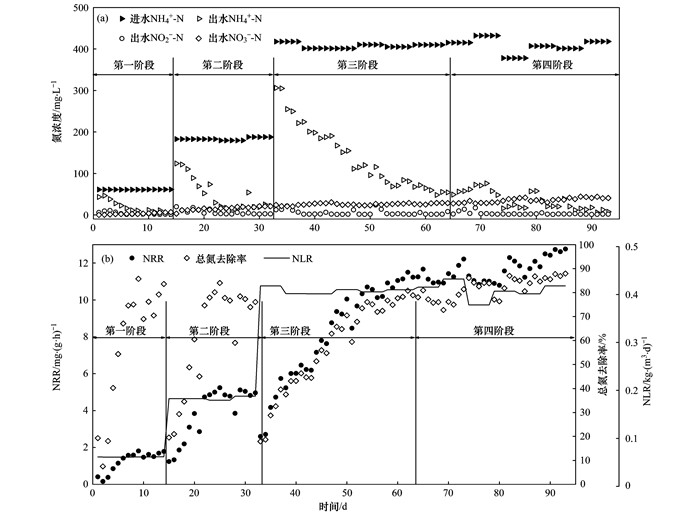
|
图 7 长期实验双菌层组氮浓度、NRR、NLR及总氮去除率的变化情况 Fig. 7 Nitrogen concentration, NRR, NLR, and the shift in nitrogen removal rate for the double-bacteria-layer group of the long-term experiment |
第二阶段(15~32 d)为中负荷中溶解氧运行阶段, 溶解氧为1.0 mg·L-1, NH4+-N质量浓度为200 mg·L-1.此阶段内, 双菌层组总氮去除率后期稳定在80.0%左右, 出水NH4+-N质量浓度保持约19.4 mg·L-1; 而对照组总氮去除率仅为58.1%, 出水NH4+-N质量浓度仍有39 mg·L-1.推测在此阶段内, 对照组溶解氧不足, AOB亚硝化能力受到限制, 导致厌氧氨氧化反应没有足够的电子受体[24], 总氮和NH4+-N去除率大大降低.这说明包埋固定化处理, 能有效提高AOB对溶解氧的利用效率, 从而提高PN/A系统的脱氮效能.
第三阶段(33~63 d)为高负荷中溶解氧运行阶段, 溶解氧为1.0 mg·L-1, NH4+-N质量浓度为400 mg·L-1.该阶段两组的初始脱氮效能仅20.0%, 后期双菌层组总氮去除率恢复至80.8%, 未明显出现溶解氧受限的状况; 而对照组总氮去除率仅恢复至61.4%.这说明PN/A系统在溶解氧受限时, 适当提高进水NH4+-N质量浓度在一定程度上能够提高AOB对溶解氧的利用效率[25].
第四阶段(64~93 d)为高负荷高溶解氧运行阶段, 溶解氧为3.0 mg·L-1, NH4+-N浓度为400 mg·L-1.双菌层组初始总氮去除率在80.0%左右, 后期增至87.9%, NRR达到12.8 mg·(g·h)-1.而对照组总氮去除率在整个阶段期间波动上升, 最终达到81.2%, NRR达到11.8 mg·(g·h)-1.这说明在高负荷状态下, PN/A系统对溶解氧的需求量有所增加, 双菌层组总氮去除率接近理论值(88.8%), 显示了AOB和ANAMMOX污泥的良好活性; 对照组在去除了溶解氧的限制后, 总氮去除率显著增加, NRR与双菌层组较为接近.
Li等[26]发现若要使工艺长期稳定运行, NLR需小于1.0 kg·(m3·d)-1, 本文长期实验NLR后期稳定在0.4 kg·(m3·d)-1, 符合其研究结论. Miao等[10]运用ANAMMOX工艺处理废水时NRR为12.1 mg·(g·h)-1; Phan等[27]的PN/A处理系统NRR保持在16.0 mg·(g·h)-1左右, 与本文实验运行期间的NRR较为接近.
综上所述, 在一定范围内, 随着进水NH4+-N质量浓度的提高, PN/A系统对溶解氧的需求量会有所增大.而在溶解氧受限时, 适当提高进水NH4+-N质量浓度能够提高PN/A系统的脱氮效能.双菌层体系能够有效提高PN/A系统对溶解氧的利用效率, 减小外界溶解氧冲击的影响, 从而增加系统稳定性, 提高系统脱氮效能.
3 结论(1) 分别采用SBR反应器和MBR反应器驯化培养AOB污泥和ANAMMOX污泥, 高通量宏基因组测序结果显示两者的优势菌种分别为亚硝化单胞菌属(Nitrosomonas, 22.78%)和厌氧氨氧化菌属(Candidatus Jettenia, 18.69%), 证明驯化成功.
(2) 短期实验揭示了PN/A双菌层系统的运行机制:通过酸碱互补和底物浓度的反馈, 亚硝化和厌氧氨氧化反应在运行过程中交替占据主导地位, 启动PN/A反应.
(3) PN/A双菌层系统能够有效提高系统对溶解氧的利用效率, 并增强系统的稳定性和脱氮效能.在溶解氧为1.0 mg·L-1, 进水NH4+-N质量浓度分别为200 mg·L-1和400 mg·L-1时, 对照组脱氮效率仅为58.1%和61.4%, 而PN/A双菌层系统脱氮效率均稳定在80.0%左右.
(4) 溶解氧为3.0 mg·L-1, 进水NH4+-N质量浓度为400 mg·L-1时, PN/A双菌层系统总氮去除率达87.9%, NLR为0.4 kg·(m3·d)-1, NRR为12.8 mg·(g·h)-1.
| [1] | Zhang F Z, Peng Y Z, Miao L, et al. A novel simultaneous partial nitrification ANAMMOX and denitrification (SNAD) with intermittent aeration for cost-effective nitrogen removal from mature landfill leachate[J]. Chemical Engineering Journal, 2017, 313: 619-628. DOI:10.1016/j.cej.2016.12.105 |
| [2] | Giustinianovich E A, Campos J L, Roeckel M D, et al. Influence of biomass acclimation on the performance of a partial nitritation-anammox reactor treating industrial saline effluents[J]. Chemosphere, 2018, 194: 131-138. DOI:10.1016/j.chemosphere.2017.11.146 |
| [3] |
单晓静, 于德爽, 李津, 等. 海水优化ANAMMOX包埋固定化及其处理含海水污水的脱氮性能[J]. 环境科学, 2018, 39(4): 1677-1687. Shan X J, Yu D S, Li J, et al. Characteristics and performance of embedded ANAMMOX bacteria in treating saline wastewater[J]. Environmental Science, 2018, 39(4): 1677-1687. |
| [4] | Li X J, Sun S, Badgley B D, et al. Nitrogen removal by granular nitritation-anammox in an upflow membrane-aerated biofilm reactor[J]. Water Research, 2016, 94: 23-31. DOI:10.1016/j.watres.2016.02.031 |
| [5] | Qiao S, Tian T, Duan X M, et al. Novel single-stage autotrophic nitrogen removal via co-immobilizing partial nitrifying and anammox biomass[J]. Chemical Engineering Journal, 2013, 230: 19-26. DOI:10.1016/j.cej.2013.06.048 |
| [6] | Chou W P, Tseng S K, Ho C M. Anaerobic ammonium oxidation improvement via a novel capsule bioreactor[J]. Environmental Technology, 2012, 33(18): 2105-2110. DOI:10.1080/09593330.2012.660647 |
| [7] |
陈光辉, 李军, 邓海亮, 等. 厌氧氨氧化污泥包埋固定化及其脱氮效能[J]. 北京工业大学学报, 2015, 41(4): 612-620. Chen G H, Li J, Deng H L, et al. Nitrogen removal performance of immobilized anammox sludge[J]. Journal of Beijing University of Technology, 2015, 41(4): 612-620. DOI:10.11936/bjutxb2014070052 |
| [8] | Ali M, Oshiki M, Rathnayake L, et al. Rapid and successful start-up of anammox process by immobilizing the minimal quantity of biomass in PVA-SA gel beads[J]. Water Research, 2015, 79: 147-157. DOI:10.1016/j.watres.2015.04.024 |
| [9] | Strous M, Van Gerven E, Zheng P, et al. Ammonium removal from concentrated waste streams with the anaerobic ammonium oxidation (ANAMMOX) process in different reactor configurations[J]. Water Research, 1997, 31(8): 1955-1962. DOI:10.1016/S0043-1354(97)00055-9 |
| [10] | Miao L, Wang S Y, Cao T H, et al. Advanced nitrogen removal from landfill leachate via Anammox system based on Sequencing Biofilm Batch Reactor (SBBR):effective protection of biofilm[J]. Bioresource Technology, 2016, 220: 8-16. DOI:10.1016/j.biortech.2016.06.131 |
| [11] | Tatari K, Musovic S, Gülay A, et al. Density and distribution of nitrifying guilds in rapid sand filters for drinking water production:dominance of Nitrospira spp[J]. Water Research, 2017, 127: 239-248. DOI:10.1016/j.watres.2017.10.023 |
| [12] | Abraham W R, Strömpl C, Vancanneyt M, et al. Woodsholea maritima gen. nov., sp. nov., a marine bacterium with a low diversity of polar lipids[J]. International Journal of Systematic and Evolutionary Microbiology, 2004, 54(4): 1227-1234. DOI:10.1099/ijs.0.02943-0 |
| [13] | Nunes-Alves C. Microbial ecology:do it yourself nitrification[J]. Nature Reviews Microbiology, 2016, 14(2): 61. DOI:10.1038/nrmicro.2015.20 |
| [14] | Nam J H, Ventura J R S, Yeom I T, et al. A novel perchlorate-and nitrate-reducing bacterium, Azospira sp. PMJ[J]. Applied Microbiology and Biotechnology, 2016, 100(13): 6055-6068. DOI:10.1007/s00253-016-7401-3 |
| [15] | Kuenen J G. Anammox bacteria:from discovery to application[J]. Nature Reviews Microbiology, 2008, 6(4): 320-326. DOI:10.1038/nrmicro1857 |
| [16] | Bae H, Chung Y C, Jung J Y. Microbial community structure and occurrence of diverse autotrophic ammonium oxidizing microorganisms in the anammox process[J]. Water Science & Technology, 2010, 61(11): 2723-2732. |
| [17] |
吕亮, 赵诗惠, 韦佳敏, 等. ABR-MBR工艺处理生活污水实现短程硝化[J]. 环境科学, 2017, 38(12): 5154-5161. Lü L, Zhao S H, Wei J M, et al. Realization of shortcut nitrification in the ABR-MBR process treating domestic wastewater[J]. Environmental Science, 2017, 38(12): 5154-5161. |
| [18] | Kartal B, De Almeida N M, Maalcke W J, et al. How to make a living from anaerobic ammonium oxidation[J]. FEMS Microbiology Reviews, 2013, 37(3): 428-461. DOI:10.1111/1574-6976.12014 |
| [19] | Kartal B, Rattray J, Van Niftrik L A, et al. Candidatus "Anammoxoglobus propionicus" a new propionate oxidizing species of anaerobic ammonium oxidizing bacteria[J]. Systematic and Applied Microbiology, 2007, 30(1): 39-49. DOI:10.1016/j.syapm.2006.03.004 |
| [20] | Fahrbach M, Kuever J, Meinke R, et al. Denitratisoma oestradiolicum gen. nov., sp. nov., a 17β-oestradiol-degrading, denitrifying betaproteobacterium[J]. International Journal of Systematic and Evolutionary Microbiology, 2006, 56(7): 1547-1552. DOI:10.1099/ijs.0.63672-0 |
| [21] | Mcilroy S J, Kirkegaard R H, Dueholm M S, et al. Culture-independent analyses reveal novel anaerolineaceae as abundant primary fermenters in anaerobic digesters treating waste activated sludge[J]. Frontiers in Microbiology, 2017, 8: 1134. DOI:10.3389/fmicb.2017.01134 |
| [22] | Liang B, Wang L Y, Zhou Z C, et al. High frequency of Thermodesulfovibrio spp. and Anaerolineaceae in association with Methanoculleus spp. in a long-term incubation of n-alkanes-degrading methanogenic enrichment culture[J]. Frontiers in Microbiology, 2016, 7: 1431. |
| [23] | Li J, Zhu W Q, Dong H Y, et al. Performance and kinetics of ANAMMOX granular sludge with pH shock in a sequencing batch reactor[J]. Biodegradation, 2017, 28(4): 245-259. DOI:10.1007/s10532-017-9793-x |
| [24] | Kwak W, McCarty P L, Bae J, et al. Efficient single-stage autotrophic nitrogen removal with dilute wastewater through oxygen supply control[J]. Bioresource Technology, 2012, 123: 400-405. DOI:10.1016/j.biortech.2012.07.076 |
| [25] | Xin W, Gong B Z, Zhou J, et al. Efficient simultaneous partial nitrification, ANAMMOX and denitrification (SNAD) system equipped with a real-time dissolved oxygen (DO) intelligent control system and microbial community shifts of different substrate concentrations[J]. Water Research, 2017, 119: 201-211. DOI:10.1016/j.watres.2017.04.052 |
| [26] | Li H S, Zhou S Q, Ma W H, et al. Long-term performance and microbial ecology of a two-stage PN-ANAMMOX process treating mature landfill leachate[J]. Bioresource Technology, 2014, 159: 404-411. DOI:10.1016/j.biortech.2014.02.054 |
| [27] | Phan T N, Van Truong T T, Ha N B, et al. High rate nitrogen removal by ANAMMOX internal circulation reactor (IC) for old landfill leachate treatment[J]. Bioresource Technology, 2017, 234: 281-288. DOI:10.1016/j.biortech.2017.02.117 |
 2018, Vol. 39
2018, Vol. 39


