2. 武汉大学水利水电学院, 武汉 430072;
3. 湖北工业大学土木建筑与环境学院, 河湖生态修复与藻类利用湖北省重点实验室, 武汉 430068;
4. 九江学院鄱阳湖生态经济研究中心, 九江 332005;
5. 中国科学院青岛生物能源与过程研究所, 青岛 266101
2. School of Water Resources and Hydropower Engineering, Wuhan University, Wuhan 430072, China;
3. Key Laboratory of Ecological Restoration of River-lakes and Algal Utilization, College of Resources and Environment Sciences, Hubei University of Technology, Wuhan 430068, China;
4. Poyang Lake Eco-economy Research Center of Jiujiang University, Jiujiang 332005, China;
5. Qingdao Institute of Bioenergy and Bioprocess Technology, Chinese Academy of Sciences, Qingdao 266101, China
随着沼气工程的大规模发展, 大量富营养的猪粪沼液废水对水体环境以及人类健康造成严重危害[1, 2].猪粪沼液废水是一种较难处理的有机废水, 具有高浓度氮磷、成分复杂等特点.在未得到妥善处理的情况下, 其中的氮、磷以及有机物等会导致水体富营养化、地下水污染, 造成人类饮用水的污染等水环境问题, 严重破坏水体生态平衡.另一方面, 废水中氨的释放也会对大气带来严重的污染.因此寻求一种有效、简单且经济的猪粪沼液废水处理技术极为重要.
国内外对猪粪沼液废水的处理已进行大量的研究, 研究人员也相继开发了不同的猪粪沼液废水处理工艺[3], 主要包括还田模式、自然处理模式和厌氧发酵产沼气模式等[4~6].传统的处理方式虽能在一定程度上达到除污的目的, 但也会带来二次污染[7].目前, 利用微藻处理猪粪沼液废水的技术已得到国内外学者的印证[8].猪粪沼液废水中含有大量藻类生长所需的氮、磷以及其他营养物质, 将猪粪沼液废水净化与微藻的培养相结合, 既可以达到排放标准, 降低猪粪沼液废水处理成本, 又可以节约微藻的培养成本, 同时还可利用微藻生物质中的高附加值产物[9, 10].但是, 传统的液体悬浮培养(如跑道池等)处理沼液因占地面积大、处理效率不高、条件不易控制、采收成本较高等问题一直未得到工艺化推广利用.
本研究采用贴壁技术培养微藻处理猪粪沼液废水.贴壁培养是将藻细胞与培养基相分离, 并将藻细胞固定在特定的生物膜材料上, 极少量的培养基液体通过附着多孔材料的背面或内部滴入以使藻细胞处于半干湿润状态, 并在一定光照强度与营养盐浓度下进行生长的培养方式.利用贴壁方式培养微藻处理猪粪沼液废水, 培养结束后省去了藻细胞离心等高能耗过程, 大大降低培养成本[10~12].尽管如此, 通过微藻贴壁培养处理猪粪沼液废水的效果还需要进一步考察研究.当前, 对于藻类细胞的生长以及生物技术方面的应用大多集中于传统的液体悬浮培养, 包括开放的培养池或是PBR反应器, 但这方面的知识信息并不适用于新型的生物膜贴壁培养方式.
小球藻在培养中油脂含量高、生长周期短、适应能力强、光合效率高, 是一种典型的较为理想的藻种资源[13].本试验将猪粪沼液废水(原水)稀释成不同比例用于小球藻的贴壁培养, 进而考察小球藻在不同稀释倍数猪粪沼液废水下的生物量增长、油脂积累、pH变化及COD、氨氮、总氮、总磷、重金属铜、锌、铁去除效率, 以确定小球藻在猪粪沼液废水中贴壁培养的最适宜生长浓度, 探究小球藻贴壁培养处理猪粪沼液废水的效果, 以期为畜禽污染控制和猪粪沼液废水深度处理提供一定的理论基础.
1 材料与方法 1.1 藻种来源与培养本试验所用小球藻(Chlorella pyrenoidosa)由湖北工业大学淡水藻种库提供.小球藻藻种培养过程所用培养基为BG11[14].
1.2 猪粪沼液废水猪粪沼液废水取自湖北省武汉市某畜禽养殖企业经厌氧发酵后的沼液污水, 取水时间为2016年9月27日10:00.猪粪沼液废水储存于18℃的温度下, 经自然沉降2 d后, 取其上清液进行试验.将猪粪沼液废水(原水)称为1倍猪粪沼液废水, 即取沉降后的上清液3 L制成培养基. 2倍猪粪沼液废水, 即取沉降后的上清液1 500 mL, 再向其中加入1 500 mL的蒸馏水, 共计3 L制成培养基.以此类推, 5倍、10倍猪粪沼液废水按上述方法稀释制成培养基.
1.3 反应器与培养方法本试验小球藻藻种培养所用反应器为玻璃柱式反应器, 内直径0.05 m, 柱高0.55 m, 工作体积0.90 L.反应器内部布置直径5 mm的玻璃通气管, 混合有1.5%CO2体积比的压缩空气(0.10 MPa)以1 mL·s-1的通气速率通过通气管从反应器底部鼓泡, 从而将藻液搅动并补充碳源.培养过程中连续光照, 培养柱表面光强60 μmol·(m2·s)-1, 培养温度20℃±1℃.
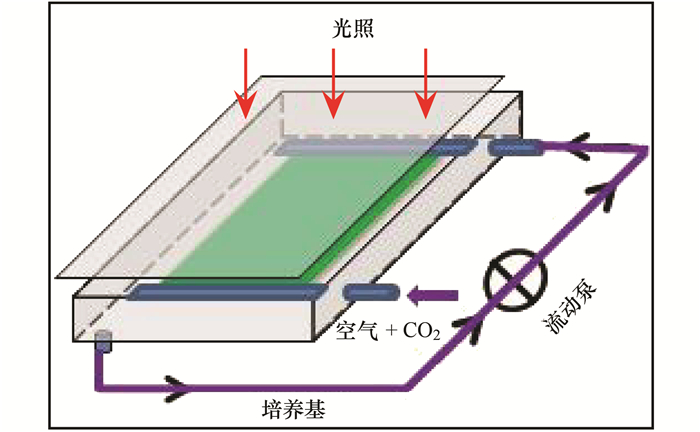
贴壁培养反应装置[15](图 1), 一块长0.40 m, 宽0.20 m, 厚3 mm的玻璃板置于0.50 m×0.30 m×0.05 m(长×宽×高)的玻璃腔中, 将玻璃板的一面附滤纸, 并接受正上方的光照.将小球藻藻种经过培养至对数期后, 接种相同浓度藻液于醋酸纤维素膜上, 再将其附着于玻璃板的滤纸上, 将附有藻种的玻璃板放入玻璃腔内, 通过循环泵滴加保持小球藻附着材料的湿润状态, 同时为保障玻璃腔内的稳定环境, 用保鲜膜封住玻璃腔的一面.为了培养液更均匀地渗入藻细胞内, 将玻璃培养缸放置一定角度, 荧光灯置于培养腔正上方提供光源.猪粪沼液废水贴壁培养小球藻时未通CO2, 以空气鼓泡代替, 每2 d取样一次, 共培养8 d.其他外界培养条件与藻种液体培养条件相同.
|
图 1 微藻贴壁培养装置示意 Fig. 1 Attached cultivation device for microalgae |
将0.45 μm, 直径50 mm, 面积为0.001 m2的醋酸纤维滤膜煮沸3次后, 在105℃烘箱中烘至恒重(W1), 将待测藻样(DW)用去离子水冲洗至烧杯中, 并倒入抽滤装置内抽滤至已称重的滤膜上, 将附着藻的滤膜放入105℃烘箱中烘至恒重(W2), 用分析天平称量即为藻样重量(g·m-2).
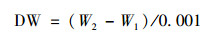
|
(1) |
小球藻总脂含量的测定采用改进的氯仿-甲醇法[16].收集藻细胞, 用一定量蒸馏水冲洗离心后冷冻干燥.称取50 mg左右(重量W1)藻粉于研钵中, 加入200 mg已烘干的石英砂, 研碎后加入5 mL甲醇, 2.5 mL氯仿, 高速振荡5 min.摇床12 h, 离心取出上清7.5 mL置于新管1.向固相中再加入5 mL甲醇, 2.5 mL氯仿, 高速振荡5 min, 摇床2 h, 离心取出上清7.5 mL置于新管1, 后加入5 mL氯仿和9 mL体积分数为1%的NaCl溶液, 保证最终体系为甲醇:氯仿:1%NaCl=2:2:1.8, 振荡混匀.将新管1于8 000 r·min-1下离心10 min, 去上清, 下层液转移入20 mL干净玻璃管(已称重W2).吹氮气+61℃水浴, 约10 min待氯仿挥发殆尽后, 于105℃烘3 h, 冷却后, 称重W3.
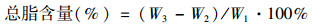
|
(2) |
取贴壁培养循环装置中猪粪沼液废水, 每2 d分别对pH、NH4+-N、TN、TP及COD进行测定. pH的测定应用pH计; NH4+-N测量采用纳氏试剂分光光度法(GB 7479-1987); TN测定采用过硫酸钾消解紫外分光光度法(GB 11894-1989); TP测量采用钼酸铵分光光度法(GB 11893-1989); COD的测定采用重铬酸钾氧化处理法(GB 11914-1989).
1.4.4 贴壁培养基中重金属Cu2+、Zn2+、Fe2+浓度的测定重金属Cu2+、Zn2+、Fe2+的含量测定采用AAnalyst 400原子吸收分光光度计. Fe2+采用火焰原子吸收分光光度法(GB 11911-89), 检出限为0.03 mg·L-1; Cu2+、Zn2+都采用原子吸收分光光度法(GB 7475-87), 检出限均为0.05 mg·L-1.
1.5 试验数据分析方法数据采用统计软件SPSS 10.0进行单因素方差分析, 采用LSD和Tukey HSD法进行统计检验(P<0.05).试验中, 曲线作图及拟合采用Origin完成.
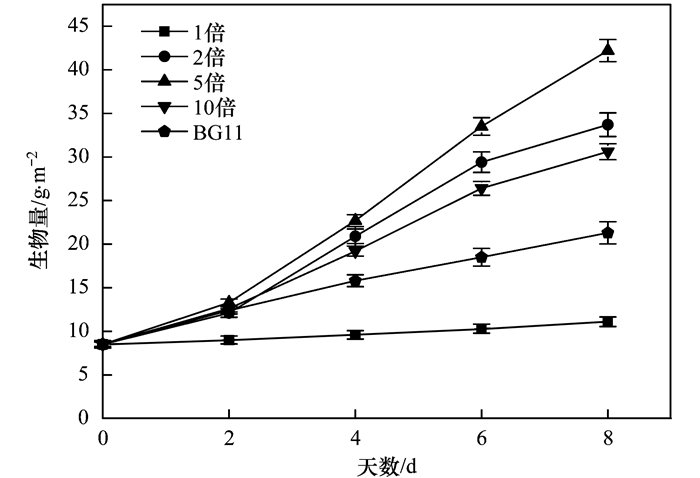
2 结果与讨论 2.1 贴壁培养小球藻在不同稀释倍数猪粪沼液废水中生长状况本试验中, 试验各处理组的小球藻的生长情况存在较大的差异(图 2).试验初期(2 d内), 各组的初始小球藻生物量均为8.50 g·m-2. BG11培养基下的小球藻的生长情况作为空白对照, 经过8 d培养后, 其生物量仅为21.30 g·m-2, 相应的生物产率是1.60 g·(m2·d)-1.各梯度下, 其中除了小球藻在稀释浓度为1倍猪粪沼液废水中没有明显生长, 其他梯度组小球藻生物量都明显增加, 各组生物量变化趋势相近, 随着培养时间的延长而增加.各梯度下小球藻生物量变化趋势为:初期上升速度较快, 此后生物量增长幅度较小.经过8 d培养, 在各梯度猪粪沼液废水生长下小球藻生物量按大小顺序排列依次是5倍>2倍>10倍>BG11>1倍.
|
图 2 贴壁小球藻在不同稀释倍数猪粪沼液废水下生物量的变化 Fig. 2 Growth curves of Chlorella pyrenoidosa under attached cultivation condition for the various dilution ratios of piggery wastewater |
由此可知, 猪粪沼液废水稀释5倍的培养条件下, 相较于其他处理组, 其生长最好, 从图 2中可明显看出, 第4 d起该条件下的小球藻生物量便明显高于其它浓度梯度, 培养8 d后小球藻生物量高达42.20 g·m-2, 生物产率为4.21 g·(m2·d)-1.在未经稀释的猪粪沼液废水(1倍)中培养小球藻, 培养相同时间后生物产率仅为0.33 g·(m2·d)-1.稀释2倍的猪粪沼液废水, 其中的小球藻生物产率只有3.15 g·(m2·d)-1.在一定范围内, 氮磷浓度越高, 小球藻生长越快[17], 超过一定范围, 小球藻生长反之越慢, 进而影响生物量的积累. 1倍处理组的猪粪沼液废水的氮磷浓度较之于小球藻生长适宜所需要的氮磷浓度要高很多, 一定程度上抑制了藻细胞的生长, 该条件下小球藻的生物量要明显低于稀释5倍条件下的值. BG11培养基是小球藻正常生长的营养盐条件, 但从图 2可知BG11培养条件下的小球藻的生物量低于稀释2倍培养条件下的小球藻的生物量.由于猪粪沼液废水的营养成分较充裕, 而稀释2倍的猪粪沼液废水中, 营养成分浓度高于BG11, 但又未达到抑制小球藻生长的高浓度水平, 因此生物量积累情况优于BG11培养的值.另外, 10倍稀释倍数下小球藻的生物量也低于稀释5倍时的值, 生物产率只有2.76 g·(m2·d)-1.猪粪沼液废水稀释10倍的培养条件下, 可能因为猪粪沼液废水被过分稀释后, 其中的营养盐含量较低, 小球藻在其中的生长因营养盐浓度过低而受到抑制.
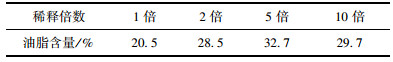
2.2 贴壁培养小球藻在不同稀释倍数猪粪沼液废水中油脂积累状况根据1.4.2节中油脂的测定方法, 各处理组的油脂的测定值见表 1.猪粪沼液废水稀释1倍的培养条件下, 油脂含量为20.5%;猪粪沼液废水稀释2倍的培养条件下, 油脂含量为28.5%;猪粪沼液废水稀释5倍的培养条件下, 油脂含量为32.7%;猪粪沼液废水稀释10倍的培养条件下, 油脂含量为29.7%.比较而言, 沼液稀释5倍的条件下油脂含量高.
|
|
表 1 贴壁小球藻在不同稀释倍数猪粪沼液废水下油脂的含量 Table 1 Oil content of Chlorella pyrenoidosa under attached cultivation condition for the various dilution ratios of piggery wastewater |
张桂艳等[18]通过重要理化因子对小球藻生长和油脂产量的影响进行试验, 研究发现氮浓度变化对小球藻的生长和油脂积累都有明显影响.王翠等[19]研究了pH值对猪粪沼液废水培养小球藻生长及油含量积累情况的影响.研究证实弱碱性条件下小球藻细胞油脂积累更有优势.前面研究证明, 猪粪沼液废水稀释5倍条件下小球藻生长最好, 生物量积累最佳.相应地在藻细胞生长的稳定期后, 由细胞内部其他组分转换为油脂的含量也越多[20~22].各猪粪沼液废水稀释培养条件下, 除了原水(1倍)中藻细胞油脂含量较低, 其它两个处理组的藻细胞油脂含量相差不大.低浓度猪粪沼液废水中的营养盐包括氮源含量均较少, 小球藻在其中生长过程较慢, 生物量积累不多.但是, 一般情况下, 当微藻生长受到胁迫或限制时, 油脂含量反而会提高.因此稀释10倍的油脂含量高于稀释2倍的处理组的油脂含量.
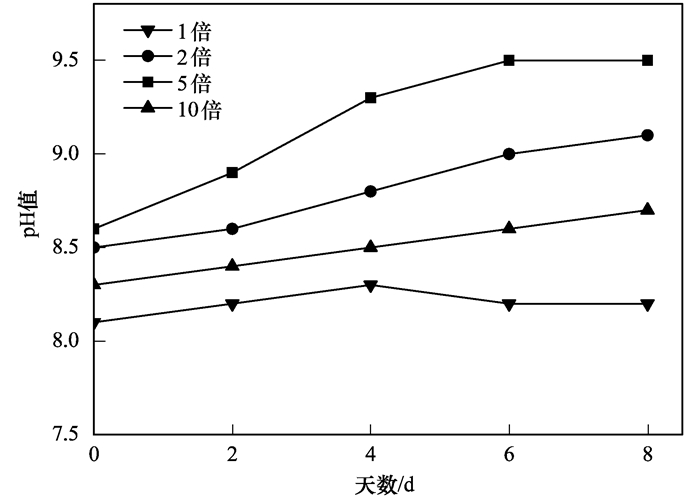
2.3 不同稀释倍数下猪粪沼液废水的pH的变化pH值是衡量藻类生长环境的重要指标, 它主要是通过改变培养基的酸碱度, 进而影响培养基溶液的渗透压, 同时在呼吸作用中影响微藻对有机碳源的利用效果, 因此pH是影响藻类生长代谢的重要因子之一[23~26].小球藻生长的pH值范围为3.5~9.5.试验期间, 不同稀释倍数猪粪沼液废水培养条件下的pH变化特性如图 3所示.从中可知, 各处理组培养基的pH在8.1~9.5之间变化.各处理组的变化趋势:试验第2 d, 培养基的pH均上升, 之后6 d变化幅度都相对平稳.试验初期测定此猪粪沼液废水pH为8.1.试验结果表明, 经过8 d培养, 稀释1倍的培养基pH为8.2, 稀释2倍的培养基pH为9.1, 稀释5倍的培养基pH为9.5, 稀释10倍的培养基pH为8.7, 各处理组间培养基pH差异较为明显, pH按大小顺序依次为5倍>2倍>10倍>1倍.由于培养基中的pH主要是由二氧化碳的电离平衡决定, 小球藻的光合作用是以水体中二氧化碳、碳酸根、碳酸氢根为原料, 光合作用越强, 电离平衡就往氢氧根方向移动, 造成pH升高.结合2.1节已经得出稀释5倍条件下, 小球藻的生物量最高, 那么, 在光照强度、温度、培养基总量、初始接种量等相同的培养条件下, 再结合图 2分析, 不难得出, pH随小球藻生物量的增加而升高, 从而使得培养基呈弱碱性.因此, 比较而言弱碱性条件有利于油脂的积累, 这也与Guckert等[27]的研究相吻合.
|
图 3 不同稀释倍数猪粪沼液废水中pH的变化 Fig. 3 Changes of pH for the various dilution ratios of piggery wastewater |
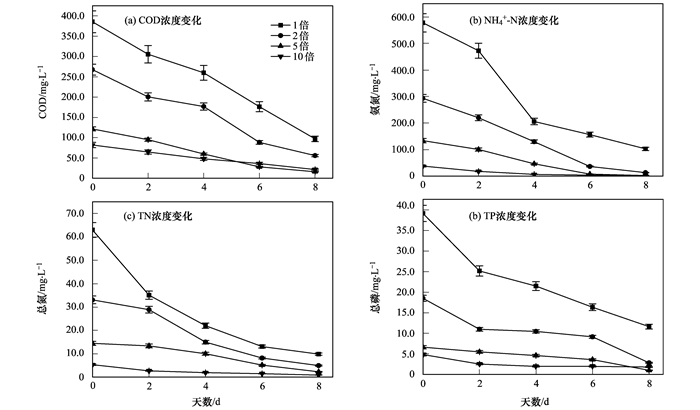
小球藻培养一个周期后(8 d), 不同稀释倍数猪粪沼液废水中COD、NH4+-N、TN、TP浓度的变化情况如图 4所示.
|
图 4 不同稀释倍数猪粪沼液废水中营养盐的浓度 Fig. 4 Concentrations of nutrients for the various dilution ratios of piggery wastewater |
由于藻细胞在生长过程中需要利用废水中有机物质进行自身物质的合成, COD是沼液中的主要营养物质, 也是养殖业需要考虑能否达标排放的重要指标.通过对猪粪沼液废水稀释一定的倍数培养小球藻, 同时观察其对猪粪沼液废水净化的效果.从图 4(a)中可以看出, 猪粪沼液废水稀释倍数为1、2、5、10倍的培养液COD初始值分别为385.77、267.87、116.10、82.00 mg·L-1.培养8 d, 相应的各处理组猪粪沼液废水中的COD值分别下降为97.19、55.99、16.12、21.53 mg·L-1, 去除效率分别为74.8%、79.1%、86.8%、73.7%.本试验表明, 小球藻在猪粪沼液废水稀释倍数为1、2、5倍的培养基中能够生长良好, 在培养周期内COD下降速度非常快, 去除COD的效率随着培养基稀释倍数的增加而增加.但是猪粪沼液废水稀释10倍时小球藻去除COD速率缓慢, 这或许是因为稀释倍数较大, 营养物质质量浓度过低, 培养基中低浓度的有机质无法较好地满足小球藻所需物质合成的需要.因此小球藻在猪粪沼液废水稀释倍数为5倍时去除COD效率最好, 其对于COD的去除效果要远远高于传统的液体培养处理法[28].
图 4(b)为不同处理组NH4+-N的去除效果.初始猪粪沼液废水的NH4+-N值为578.27 mg·L-1, 试验第1 d, 猪粪沼液废水稀释倍数为2、5、10倍的混合液中的NH4+-N值分别为293.72、134.17、38.20 mg·L-1.试验开始后各处理组NH4+-N质量浓度迅速下降, 前4 d的变化相当明显.试验结束第8 d, 各处理组中沼液的NH4+-N值分别降低为103.19、13.61、2.67、3.10 mg·L-1, 去除效率分别为82.2%、87.8%、94.1%、91.9%.微藻对培养液中氨氮的去除方式有两种, 一是藻类的生长吸收消耗的易吸收氮源主要是氨氮, 用于合成自身细胞所需的有机物; 二是微藻光合作用时, 溶液中pH值升高, 从而导致氨氮的挥发[29].本试验中, 稀释10倍的培养基中, 混合液的氨氮浓度相对较低, 但仍然可以提供满足小球藻生长的条件.而稀释1倍和2倍的培养基由于营养成分略高于小球藻适宜的生长条件, 有抑制小球藻生长的可能性.综上所述稀释5倍的处理组NH4+-N值的去除效果是最好的.
从图 4(c)可知, 猪粪沼液废水稀释倍数为1、2、5、10倍的混合液中的TN初始值分别为63.03、33.09、14.49、5.34 mg·L-1.试验第8 d, 各处理组中猪粪沼液废水中的TN值分别降低为9.87、4.95、2.29、0.88 mg·L-1, 相应地去除效率分别为84.3%、85.0%、85.2%、83.6%.微藻对于沼液中氮化合物的去除主要是通过其吸收作用, 将含氮化合物通过自养作用合成藻细胞中氨基酸以及蛋白质等物质[30].由于猪粪沼液废水稀释10倍时, 低浓度的营养物质虽对小球藻的生长有一定影响, 但去除TN效率仍然可以达到83.6%.其他处理组的处理效率也均在80.0%以上.因此小球藻对于猪粪沼液废水中TN去除效果很好.
图 4(d), 初始猪粪沼液废水的TP值为39.12 mg·L-1, 猪粪沼液废水稀释2、5、10倍的混合液中TP值分别为18.53、6.65、4.86 mg·L-1.培养至第8 d, 各处理组培养基中的TP值分别降低为11.63、2.86、1.05、1.84 mg·L-1, 去除效率分别为70.3%、84.5%、84.3%、62.1%.同样, 微藻对磷的去除途径主要有两种:一是微藻生长同化培养液中的磷元素, 合成自身的营养物质.二是藻的光合作用使溶液中pH值上升, 磷元素以难溶盐的形式沉淀下来[29]. 图 4(d)反映了各组猪粪沼液废水中TP的去除趋势, 很明显随着培养时间的延长, TP逐渐被小球藻利用代谢, 效率均达到83%以上, 高于Ruan等[31]用传统方式的净化效果.当猪粪沼液废水稀释5倍时TP的浓度下降速度较为均匀并且下降速率最高.
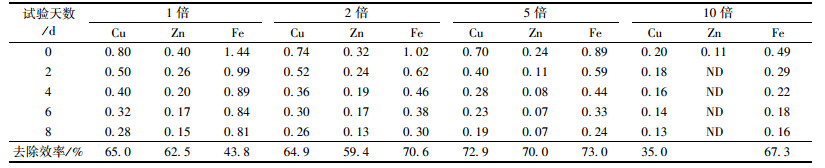
2.5 不同稀释倍数下小球藻对重金属Cu2+、Fe2+、Zn2+的去除效果研究人员发现有些藻体对重金属具有一定的富集能力, 这使藻类作为生物吸附剂修复水体重金属污染成为可能.对重金属Cu2+、Fe2+、Zn2+共存情况下的猪粪沼液废水进行定期取样检测, 测定小球藻对Cu2+、Fe2+、Zn2+的去除情况, 如表 2所示.
|
|
表 2 不同稀释倍数猪粪沼液废水中重金属浓度/mg·L-1 Table 2 Concentrations of heavy metals in attached cultivation for the various dilution ratios of piggery wastewater/mg·L-1 |
从表 2中可以看出, 小球藻对Cu2+、Fe2+、Zn2+的去除是个较为快速的过程.试验开始2 d后, 各处理组中Cu2+、Fe2+、Zn2+的浓度迅速下降, 培养6 d后逐渐趋于平缓.稀释1、2、5、10倍的猪粪沼液废水对于Cu2+的去除效率分别为:65.0%、64.9%、72.9%、35.0%.其中去除效率最高的是稀释5倍的培养基, Cu2+浓度由初始0.70 mg·L-1下降到了0.19 mg·L-1.稀释1、2、5、10倍的猪粪沼液废水对于Fe2+的除去效率分别为43.8%、70.6%、73.0%、67.3%.此时, 去除效率最高的也是稀释5倍的猪粪沼液废水, 该培养基中的Fe2+浓度由0.89 mg·L-1降低到0.24 mg·L-1.稀释1、2、5倍的猪粪沼液废水对于Zn2+的除去效率分别为62.5%、59.4%、70.0%.由于Zn2+使用1.4.4节中试验方法测试时, 其检出限为0.05 mg·L-1. 10倍的猪粪沼液废水中Zn2+的初始含量为0.11 mg·L-1, 第2 d其含量已经检测不到.以上分析可知, 稀释5倍的培养基对于重金属Cu2+、Fe2+、Zn2+的吸收效果是最好的.
5倍稀释倍数的培养基对于重金属Cu2+、Fe2+、Zn2+的吸收效果表明, 其吸附能力大小依次为:Fe2+>Cu2+>Zn2+.吴海锁等[32]研究了多种金属离子共存时, 小球藻对金属的吸附具有一定的选择性, 其对Cu2+的吸附能力强于Zn2+, 且不同离子间有一定的抑制作用, 这与本研究结果相似.各处理组由于重金属浓度还未达到毒害藻体死亡的含量, 因此4个处理组的去除效率都是逐渐升高的.这与藻细胞对重金属的吸附机制有关, 吸附的最初时期金属离子通过络合、离子交换等作用吸附在细胞壁上, 这是一个快速吸附的过程, 此后在细胞代谢的作用下吸附在表面的金属离子被转运至细胞体内, 重金属被藻细胞富集, 因此去除率随时间慢慢上升.但是1倍、2倍处理组对重金属离子的去除效果并未像5倍时那么好, 而10倍处理组由于稀释倍数过高, 最终的去除效果也并非如5倍时明显.这可能是由于金属阳离子进入藻液时立即被细胞壁上的羟基(—OH)、羧基(—COOH)等基团水解释放的阴离子和质子结合, 吸附在细胞表面, 而同时重金属对藻细胞的胁迫作用致使藻细胞生长受阻.或可能由于某一种金属进入藻液后和氨基、羧基等功能基团相互作用并大量附着在藻细胞表面[33, 34].重金属对小球藻生长有抑制作用, 低浓度下抑制效果不明显, 高浓度下显著影响藻细胞生长, 且重金属大量存在会使藻细胞破碎.但由于本试验中培养基中重金属浓度并非很高, 所以并未对小球藻正常的生长产生较大影响, 反而一定程度上可以满足小球藻生长对于微量元素的需求, 所以最终的去除效率也较明显.
3 结论(1) 小球藻贴壁培养处理猪粪沼液废水是可行的.在不同稀释倍数下(1、2、5、10倍)的猪粪沼液废水中, 小球藻均能生长.在猪粪沼液废水稀释5倍时, COD为121.72 mg·L-1, 氨氮为134.17 mg·L-1、总氮为14.49 mg·L-1、总磷为6.65 mg·L-1, 此时小球藻生长最好, 培养一个周期8 d后生物产率为4.21 g·(m2·d-1).对COD、氨氮、总氮、总磷的去除效率最高, 分别为:86.8%、94.1%、85.2%、84.3%.
(2) 猪粪沼液废水稀释5倍时, 小球藻贴壁培养藻细胞的油脂含量最高, 为32.7%, 其次是稀释2倍下, 小球藻油脂含量为28.5%.同时, 在猪粪沼液废水稀释5倍时, 小球藻贴壁培养去除重金属铜、锌、铁的效果最好, 去除率分别是72.9%、70.0%、73.0%.
| [1] | Chen X, Luo A C, Sato K, et al. An introduction of a multi-soil-layering system: a novel green technology for wastewater treatment in rural areas[J]. Water and Environment Journal, 2009, 23(4): 255-262. DOI:10.1111/wej.2009.23.issue-4 |
| [2] |
赵君怡, 张克强, 王风, 等. 猪场废水灌溉地下水中氮素的影响[J]. 生态环境学报, 2011, 20(1): 149-153. Zhao J Y, Zheng K Q, Wang F, et al. Influence of livestock wastewater irrigation on nitrogen compounds contents in groundwater[J]. Ecology and Environmental Sciences, 2011, 20(1): 149-153. |
| [3] | Ji M K, Ahn Y T, Khan M A, et al. Removal of nitrate and ammonium ions from livestock wastewater by hybrid systems composed of zero-valent iron and adsorbents[J]. Environmental Technology, 2011, 32(16): 1851-1857. DOI:10.1080/09593330.2011.565079 |
| [4] | Xiao H, Yang P, Peng H, et al. Nitrogen removal from livestock and poultry breeding wastewaters using a novel sequencing batch biofilm reactor[J]. Water Science & Technology, 2010, 62(11): 2599-2606. |
| [5] | Shi L J, Ban L T, Liu H F, et al. Study on livestock and poultry farming wastewater treatment using a hybrid baffled reactor[J]. Advanced Materials Research, 2011, 201-203: 2797-2802. DOI:10.4028/www.scientific.net/AMR.201-203 |
| [6] |
余薇薇, 张智, 毕胜兰, 等. 改良型两级A/O工艺处理畜禽养殖场的沼液研究[J]. 中国给水排水, 2011, 27(1): 8-11. Yu W W, Zhang Z, Bi S L, et al. Improved two-stage A/O process for treatment of biogas slurry from livestock and poultry breeding farm[J]. China Water & Wastewater, 2011, 27(1): 8-11. |
| [7] |
田静思, 张后虎, 张毅敏, 等. 矿化垃圾湿地处理畜禽养殖废水的研究[J]. 生态与农村环境学报, 2011, 27(2): 95-99. Tian J S, Zhang H H, Zhang Y M, et al. Treatment of livestock wastewater using wetland of mineralized refuse[J]. Journal of Ecology and Rural Environment, 2011, 27(2): 95-99. |
| [8] | de Godos I, Blanco S, García-Encina P A, et al. Long-term operation of high rate algal ponds for the bioremediation of piggery wastewaters at high loading rates[J]. Bioresource Technology, 2009, 100(19): 4332-4339. DOI:10.1016/j.biortech.2009.04.016 |
| [9] | Kale D K, Anthappan P D. Sustainable treatment of wastewater using effective microorganisms[J]. Journal of Pure and Applied Microbiology, 2012, 6(1): 333-338. |
| [10] |
张强, 邹华, 余云龙, 等. 小球藻处理养殖废水的初步研究[J]. 上海环境科学, 2011, 30(6): 249-253. Zhang Q, Zou H, Yu Y L, et al. An approach to the treatment of livestock farming wastewater by Chlorella vulgaris[J]. Shanghai Environmmental Sciences, 2011, 30(6): 249-253. |
| [11] | de Godos D I, Muñoz R, Guieysse B. Tetracycline removal during wastewater treatment in high-rate algal ponds[J]. Journal of Hazardous Materials, 2012, 229-230: 446-449. DOI:10.1016/j.jhazmat.2012.05.106 |
| [12] |
李松林, 吕军, 张峰, 等. 高浓度沼液淹灌水土系统中氮、磷和有机物的动态变化[J]. 水土保持学报, 2011, 25(2): 125-129. Li S L, Lü J, Zhang F, et al. Dynamic changes of nitrogen, phosphorus and organic matter in soil-water system in the process of biogas slurry flooding treatment[J]. Journal of Soil and Water Conservation, 2011, 25(2): 125-129. |
| [13] | Mata T M, Martins A A, Caetano N S. Microalgae for biodiesel production and other applications: a review[J]. Renewable and Sustainable Energy Reviews, 2010, 14(1): 217-232. DOI:10.1016/j.rser.2009.07.020 |
| [14] | Rippka R, Deruelles J, Waterbury J B, et al. Generic assignments, strain histories and properties of pure cultures of cyanobacteria[J]. Journal of General Microbiology, 1979, 111(1): 1-61. |
| [15] |
程鹏飞, 王艳, 杨期勇, 等. 葡萄藻生物膜贴壁培养处理含钴工业废水与烃类生产的耦合[J]. 环境科学, 2016, 37(7): 2666-2671. Cheng P F, Wang Y, Yang Q Y, et al. Coupling of hydrocarbon accumulation and cobalt removal during treatment of cobalt enriched industrial wastewater with Botryococcus braunii biofilm attached cultivation[J]. Environmental Science, 2016, 37(7): 2666-2671. |
| [16] | Bligh E G, Dyer W J. A Rapid method of total lipid extraction and purification[J]. Canadian Journal of Biochemistry and Physiology, 1959, 37(8): 911-917. DOI:10.1139/o59-099 |
| [17] | Converti A, Casazza A A, Ortiz E Y, et al. Effect of temperature and nitrogen concentration on the growth and lipid content of Nannochloropsis oculata and Chlorella vulgaris for biodiesel production[J]. Chemical Engineering and Processing: Process Intensification, 2009, 48(6): 1146-1151. DOI:10.1016/j.cep.2009.03.006 |
| [18] |
张桂艳, 温小斌, 梁芳, 等. 重要理化因子对小球藻生长和油脂产量的影响[J]. 生态学报, 2011, 31(8): 2076-2085. Zhang G Y, Wen X B, Liang F, et al. The effects of physical and chemical factors on the growth and lipid production of Chlorella[J]. Acta Ecologica Sinica, 2011, 31(8): 2076-2085. |
| [19] |
王翠, 李环, 王钦琪, 等. pH值对沼液培养的普通小球藻生长及油含量积累的影响[J]. 生物工程学报, 2010, 26(8): 1074-1079. Wang C, Li H, Wang Q Q, et al. Effect of pH on growth and lipid content of Chlorella vulgaris cultured in biogas slurry[J]. Chinese Journal of Biotechnology, 2010, 26(8): 1074-1079. |
| [20] | Takagi M, Watanabe K, Yamaberi K, et al. Limited feeding of potassium nitrate for intracellular lipid and triglyceride accumulation of Nannochloris sp. UTEX LB1999[J]. Applied Microbiology and Biotechnology, 2000, 54(1): 112-117. DOI:10.1007/s002530000333 |
| [21] | 陈峰, 姜悦. 微藻生物技术[M]. 北京: 中国轻工业出版社, 1999. |
| [22] |
杨闯, 王文国, 马丹炜, 等. 耐高浓度沼液产油小球藻的分离鉴定与特征分析[J]. 环境科学, 2015, 36(7): 2707-2712. Yang C, Wang W G, Ma D W, et al. Isolation, identification and characteristic analysis of an oil-producing Chlorella sp. tolerant to high-strength anaerobic digestion effluent[J]. Environmental Science, 2015, 36(7): 2707-2712. |
| [23] | Bernal C B, Vázquez G, Quintal I B, et al. Microalgal dynamics in batch reactors for municipal wastewater treatment containing dairy sewage water[J]. Water, Air, and Soil Pollution, 2008, 190(1): 259-270. |
| [24] | González C, Marciniak J, Villaverde S, et al. Microalgae-based processes for the biodegradation of pretreated piggery wastewaters[J]. Applied Microbiology and Biotechnology, 2008, 80(5): 891-898. DOI:10.1007/s00253-008-1571-6 |
| [25] | An J Y, Sim S J, Lee J S, et al. Hydrocarbon production from secondarily treated piggery wastewater by the green alga Botryococcus braunii[J]. Journal of Applied Phycology, 2003, 15(2): 185-191. |
| [26] | Yang C F, Ding Z Y, Zhang K C. Growth of Chlorella pyrenoidosa in wastewater from cassava ethanol fermentation[J]. World Journal of Microbiology and Biotechnology, 2008, 24(12): 2919-2925. DOI:10.1007/s11274-008-9833-0 |
| [27] | Guckert J B, Cooksey K E. Triglyceride accumulation and fatty acid profile changes in Chlorella(Chlorophyta) during high pH-induced cell cycle inhibition[J]. Journal of Phycology, 1990, 26(1): 72-79. DOI:10.1111/j.0022-3646.1990.00072.x |
| [28] |
乔慧, 陈灏, 赵玉柱, 等. 沼液处理液养殖普通小球藻的试验研究[J]. 中国沼气, 2016, 34(6): 115-120. Qiao H, Chen H, Zhao Y Z. Chlorella vulgaris cultivation with treated biogas slurry[J]. China Biogas, 2016, 34(6): 115-120. |
| [29] | 刘振强. 微藻优化培养、采收及沼液培养微藻的研究[D]. 杭州: 浙江工业大学, 2012. http://www.bigengculture.com/kejilunwen/huagong/403442.html |
| [30] |
王钦琪, 李环, 王翠, 等. 沼液培养的普通小球藻对CO2的去除[J]. 应用与环境生物学报, 2011, 17(5): 700-705. Wang Q Q, Li H, Wang C, et al. Reduction of CO2 by Chlorella vulgaris cultured in biogas slurry[J]. Chinese Journal of Applied and Environmental Biology, 2011, 17(5): 700-705. |
| [31] | Ruan R S, Jian E G, Wu X D, et al. Treatment of biogas slurry from pig industry by Chlorella vulgaris[J]. Modern Chemical Industry, 2013, 33(8): 62-64, 66. |
| [32] | 吴海锁, 张洪玲, 张爱茜, 等. 小球藻吸附重金属离子的试验研究[J]. 环境化学, 2004, 23(2): 173-177. |
| [33] | Gupta V K, Rastogi A. Biosorption of lead(Ⅱ) from aqueous solutions by non-living algal biomass Oedogonium sp. and Nostoc sp. -a comparative study[J]. Colloids and Surfaces B: Biointerfaces, 2008, 64(2): 170-178. DOI:10.1016/j.colsurfb.2008.01.019 |
| [34] | Maldonado J, de los Rios A, Esteve I, et al. Sequestration and in vivo effect of lead on DE2009 microalga, using high-resolution microscopic techniques[J]. Journal of Hazardous Materials, 2010, 183(1-3): 44-50. DOI:10.1016/j.jhazmat.2010.06.085 |
 2017, Vol. 38
2017, Vol. 38