2. 中国科学院生态环境研究中心环境水质学国家重点实验室, 北京 100085
2. State Key Laboratory of Environmental Aquatic Chemistry, Research Center for Eco-Environmental Sciences, Chinese Academy of Sciences, Beijing 100085, China
氰根离子(CN-) 作为强络合剂,可与许多金属离子形成络合物,被广泛应用于冶金和电镀等行业[1].铜氰络合物是这些行业废水中比较常见的一种污染物,铜元素可在生物体内富集,进一步转化为毒性更大的重金属有机化合物,并随食物链进入人体,危害人体健康;氰化物属于剧毒物质,它能麻痹人体呼吸系统导致人体窒息死亡[2].因此各国的废水排放标准中对氰化物和铜都设有严格的排放限值.近年来,铜氰络合物的污染问题日益严重,已经成为环境保护中亟待解决的严重问题之一.
铜氰络合物在废水中主要以CN-、Cu (CN)2-、Cu (CN)32-和Cu (CN)43-这4种形式存在[3],当废水pH小于9时,氰根易与H+结合,生成极易挥发的剧毒性气体HCN,严重危害生态平衡和人类健康[4],因此对含氰废水的处理必须在碱性条件下进行.在碱性条件下,Cu+和CN-形成的配位键十分稳定[5],采用常规的水解沉淀等方法难以对铜氰络合物废水达到很好的去除效果.目前处理铜氰废水的方法主要为碱式氯化法、物化沉淀法、膜吸收法、芬顿试剂氧化法、生物法、光催化法和电化学法等[6~11].上述方法在处理铜氰废水方面都具有一定效果,但也存在相应的缺陷.如物化沉淀法,需要添加大量化学试剂,成本高,且处理效果差[12];光催化氧化法,光生空穴与光生电子容易发生复合,致使光催化效率低下[13];碱式氯化法在处理铜氰废水过程中易产生有毒副产物[14].因此,寻找绿色高效的铜氰废水处理方法迫在眉睫.
过硫酸钾(K2S2O8) 作为一种绿色清洁氧化剂,以其强氧化性、无选择性、无二次污染等优点被广泛应用于水处理领域. K2S2O8在过渡金属离子、紫外光、碱、热和电的作用下能够产生具有强氧化性的硫酸根自由基(SO4·-)[15~19],SO4·-的强氧化性多被应用于有机废水处理. Zhang等[20]对K2S2O8氧化去除2, 4-二氯苯酚进行了研究. Moussavi等[21]对紫外/K2S2O8氧化去除废水中的氰化物进行了研究.目前人们更多聚焦于K2S2O8氧化去除有机污染物方面的研究,而鲜有关于K2S2O8氧化去除含氰化物废水方面的报道.因此,本实验采用K2S2O8氧化去除铜氰络合物废水[Cu (CN)32-],探究K2S2O8量与铜氰络合比对CN-去除率的影响,同时研究相关的反应机制.
1 材料与方法 1.1 试剂与仪器过硫酸钾(K2S2O8)、浓硫酸(H2SO4)、氢氧化钠(NaOH)、氰化钠(NaCN)、磷酸(H3PO4)、氰化亚铜(CuCN)、乙二胺四乙酸二钠(C10H14N2O8Na2·2H2O)、碘化汞(HgI2)、异烟酸(C6H5NO2)、巴比妥酸(C4H4N2O3)、氯胺T (C7H7ClNNaO2S·3H2O)、磷酸二氢钾(KH2PO4)、酒石酸钾钠(C4H4KNaO6·4H2O)、亚硝酸钠(NaNO2)、叔丁醇(C4H10O) 和无水乙醇(C2H6O) 均购自国药集团化学试剂有限公司;5, 5-二甲基-1-氧化吡咯(DMPO) 购自西格玛奥德里奇公司.所购买的试剂均为分析纯.
紫外可见分光光度计(T6新世纪,北京普析通用仪器有限责任公司),磁力搅拌器(德国艾卡仪器设备有限公司),有机玻璃反应器(规格为6 cm×5 cm×5 cm).
1.2 实验方法(1) 实验步骤
Cu (CN)32-废水配制方法: ①配制25 mmol·L-1的NaOH溶液;②CN-总浓度为0.90 mmol·L-1,按n(Cu+):n(CN-) 分别为1:2、1:3和1:5配制,计算并称取相应质量的NaCN和CuCN;③将称取的NaCN分别溶于已配制的NaOH溶液中;④将称取的CuCN分别溶于上述碱性NaCN溶液中,搅拌混匀即为不同铜氰络合比的模拟废水.
游离态氰根(CN-) 废水配制方法: ①配制25 mmol·L-1的NaOH溶液;②CN-总量为0.90 mmol·L-1,计算并称取相应质量的NaCN;③将NaCN溶于已配制的NaOH溶液即得到游离态氰根模拟废水.
含氰废水的pH必须保持在碱性以防HCN逸出危害人体健康[22].因此实验过程中所有反应溶液初始pH均使用H2SO4(3.0 mol·L-1) 和NaOH溶液(25 mol·L-1) 调节至12.00.反应开始前取100 mL模拟废水于有机玻璃反应器中,调节初始pH为12.00并置于磁力搅拌器上,反应器外壁包裹锡箔纸避光.加入一定量的K2S2O8到100 mL模拟废水中即开始反应.不同反应时刻取样后立即加入NaNO2溶液猝灭残余K2S2O8终止反应,经蒸馏后采用紫外-可见分光光度法进行浓度分析.
(2) 表征及分析方法
总氰化物的测定方法:对于络合态氰化物,首先在水样中加入磷酸和Na2EDTA,在pH小于2.0的条件下加热蒸馏并用NaOH溶液吸收,此后络合态氰化物全部变成了游离态氰化物,然后采用异烟酸-巴比妥酸紫外分光光度法进行测定,检测波长为610 nm;氰酸盐(CNO-) 浓度测定需要将其酸化(pH 1.500~2.000) 转化为氨氮来测定,氨氮浓度采用纳氏试剂紫外分光光度法测定,检测波长为420 nm[23].重金属的含量使用电感耦合等离子体发射光谱仪(OPTIMA 200,珀金埃尔默股份有限公司,美国) 进行测定;溶液中NO2-和NO3-采用离子色谱法进行测定(ICS-2000,赛默飞世尔科技公司,美国);以DMPO为硫酸根自由基捕获剂,采用电子自旋共振波谱仪(ESP-300E,布鲁克公司,德国) 检测反应过程中的硫酸根自由基;反应过程中产生的固体悬浮物利用X射线衍射仪(X'Pert PRO MPD,帕纳科分析仪器有限公司,荷兰) 进行物相分析.
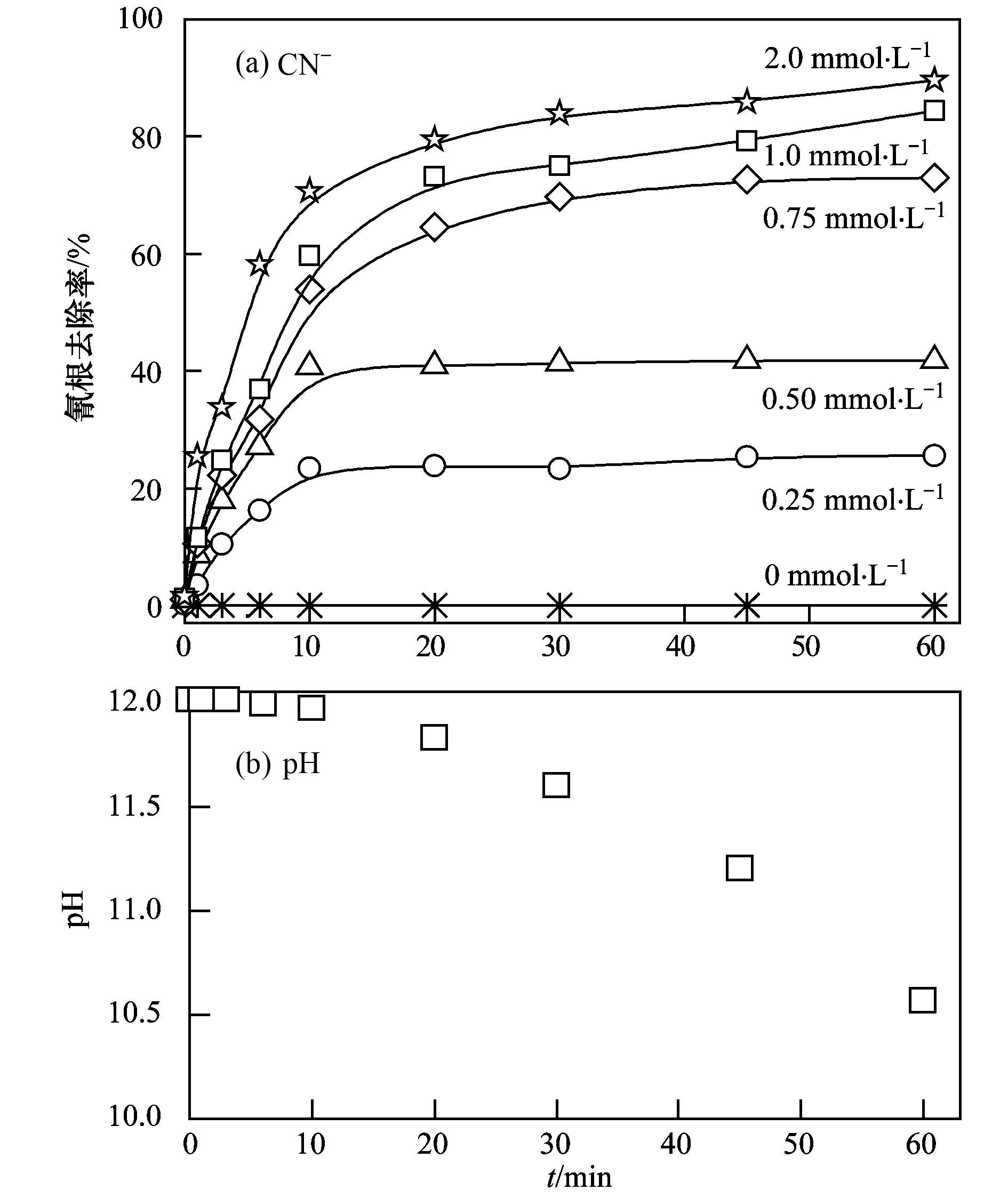
2 结果与讨论 2.1 K2S2O8浓度对Cu (CN)32-中CN-去除率的影响K2S2O8浓度对Cu (CN)32-废水中CN-去除效果具有重要影响,结果如图 1(a)所示.从中可以看出,CN-去除率随着K2S2O8浓度的增加而变大.当K2S2O8浓度为0.25 mmol·L-1时,CN-的去除率20 min后趋于平衡,60 min仅去除25.5%;将K2S2O8浓度由0.25 mmol·L-1增加至2.0 mmol·L-1时,CN-去除率达到89.6%,在0.75 mmol·L-1以后,CN-去除率增幅变小.这是因为,K2S2O8浓度在0.75~2.0 mmol·L-1时,溶液中可能产生大量的SO4·-,过多的SO4·-发生猝灭反应[24],降低了SO4·-的利用率,减小了CN-去除率增加的幅度. 图 1(b)反映了反应过程中pH的变化.溶液pH值随着反应进行逐渐降低,反应结束后pH值为10.57,大于9.000,所以反应过程中不会有CN-的逸出.综合实验效果与经济因素考虑,选择1.0 mmol·L-1为该体系K2S2O8投加量.
|
(a) 不同K2S2O8条件下CN-去除率随时间变化;(b) K2S2O8为2 mmol·L-1时,反应过程中pH随时间的变化 图 1 K2S2O8对溶液pH和CN-去除的影响 Fig. 1 Effect of K2S2O8 on solution pH and the removal of CN- |
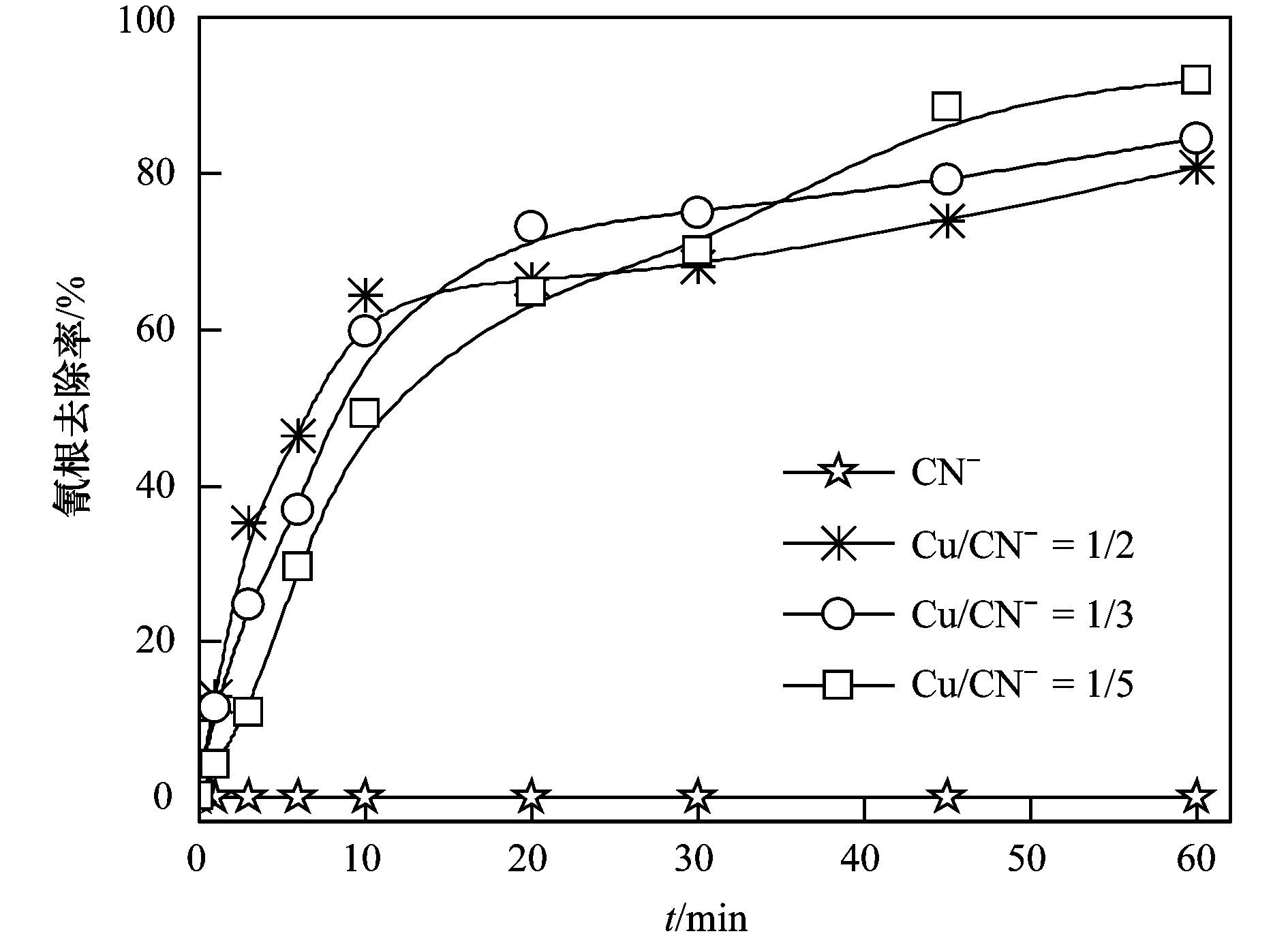
在K2S2O8浓度为1.0 mmol·L-1的条件下,研究了铜氰络合比对CN-去除的影响,结果如图 2所示. K2S2O8对游离氰根没有去除效果,但能够高效氧化去除Cu (CN)32-中的CN-.反应前10 min,CN-的去除速率随着铜氰络合比的增大而升高;60 min时CN-的去除率却随着铜氰络合比的增大而降低.有研究表明,Cu+与K2S2O8可以发生类芬顿反应[25],如方程式(1) 所示.游离CN-溶液中不存在Cu+,K2S2O8不能通过类芬顿反应产生强氧化性的SO4·-,并且单独的K2S2O8氧化能力不足以将CN-氧化去除,因此K2S2O8对游离CN-没有去除效果. CN-总浓度为0.90 mmol·L-1,铜氰络合比越大,所含铜的量越多,在相同时间内,Cu+和K2S2O8相互作用产生的强氧化性SO4·-越多,所以反应前10 min,铜氰比越大,CN-去除速率越快.有研究提出,过多的SO4·-不仅自身会发生猝灭反应,还能与S2O82-发生反应,导致自由基利用效率降低[24],所以CN-最终的去除率会随着铜氰比的增大而降低.
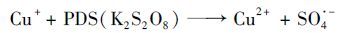
|
(1) |
|
图 2 铜氰络合比对CN-去除率的影响 Fig. 2 Removal efficiency of CN- under the conditions of different ratios of Cu+to CN- |
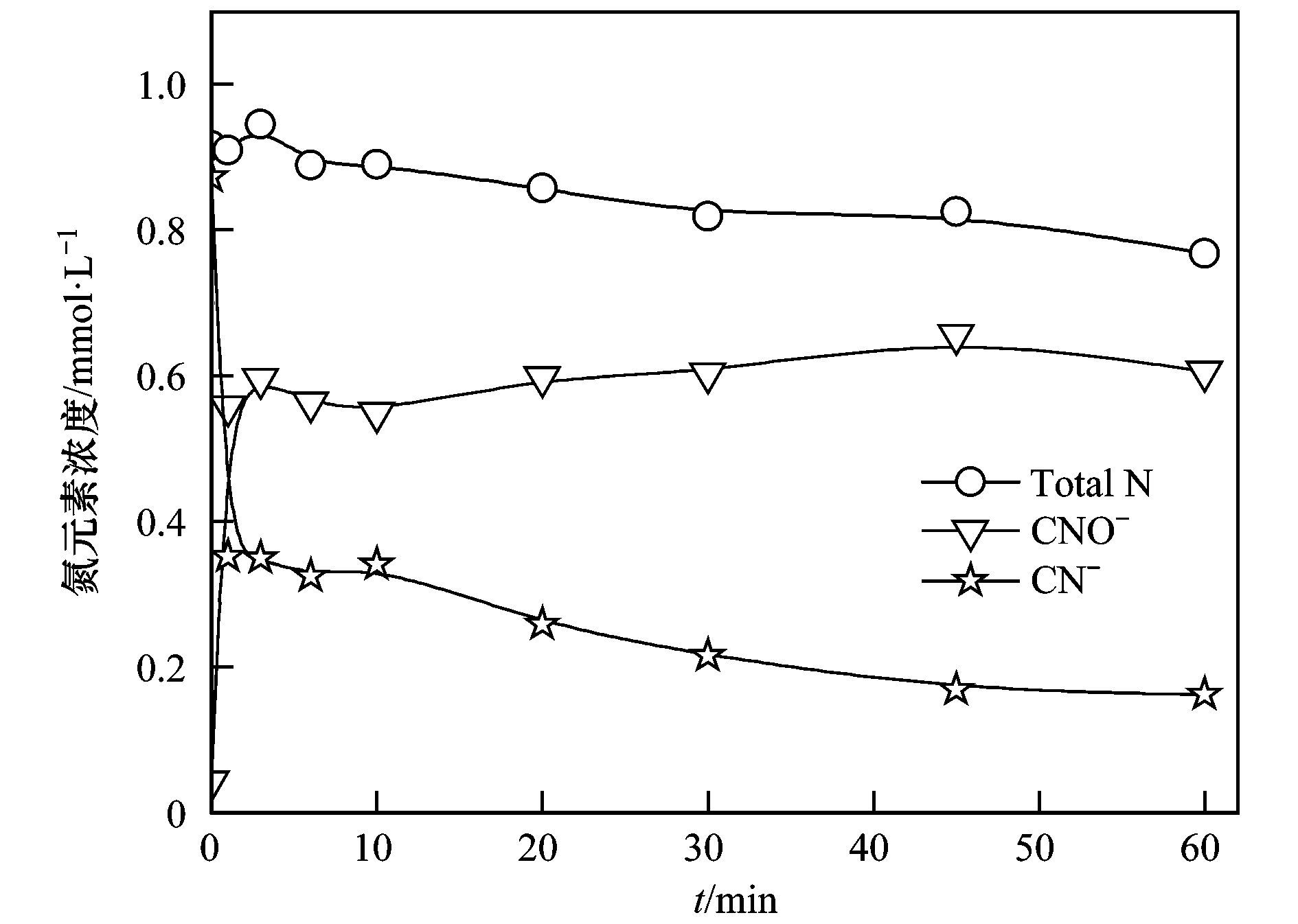
为了研究K2S2O8氧化CN-的反应途径,检测了Cu (CN)32-中CN-的氧化中间产物,结果如图 3所示.从中可以看出,随着剩余CN-浓度的降低,CNO-浓度逐渐升高.而氨氮、亚硝酸与硝酸盐都未检测到.与CN-相比,CNO-的毒性大大降低,经水解反应生成无毒化合物.不同反应时间剩余CN-浓度与生成CNO-浓度之和约等于初始CN-的总浓度,说明本实验中CNO-为CN-的主要氧化产物.
|
图 3 Cu (CN)32-氧化过程中CN-的转化 Fig. 3 Cyanide transformation during the process of Cu (CN)32- oxidation |
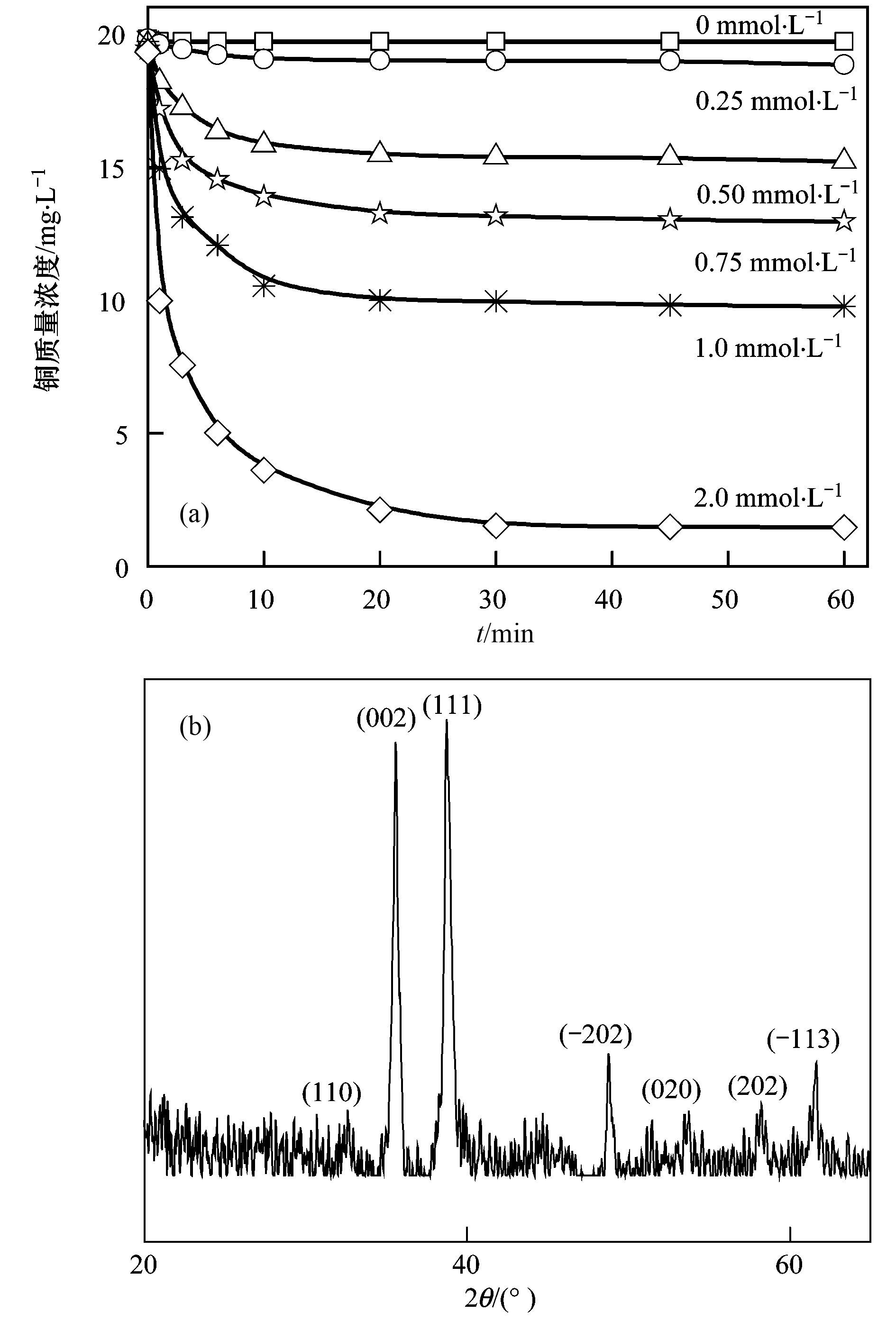
为了分析Cu (CN)32-氧化过程中Cu离子的转化,采用电感耦合等离子体发射光谱(ICP-OES) 对不同反应时刻溶液中铜离子质量浓度进行了测定.经离心分离、冷冻干燥后,利用X射线衍射光谱(XRD) 对反应过程中产生的黑色固体进行了物相分析. 图 4(a)为Cu (CN)32-氧化过程中Cu离子质量浓度变化情况,从中可以看出,溶液中Cu离子质量浓度随着反应进行逐渐降低并最终趋于稳定,且最终溶液中Cu离子质量浓度随K2S2O8量的增加而降低. 图 4(b)为反应过程中黑色固体的XRD谱图,经与标准谱图对比发现该固体与氧化铜的XRD衍射峰相匹配[26],该结果表明反应后Cu (CN)32-中的Cu+被氧化为Cu2+.这是因为,Cu (CN)32-氧化过程中,Cu+和K2S2O8发生类芬顿反应生成SO4·-,同时Cu+被氧化为Cu2+.据文献报道,生成的CuO粉末同样可以活化K2S2O8,K2S2O8吸附在CuO表面,通过外圈层相互作用改变了K2S2O8内部电子的排列,使得K2S2O8变得异常活跃,极大提高K2S2O8自身的氧化性能,但是由于CuO与K2S2O8的相互作用较弱,该过程并不产生强氧化性自由基[20].被活化的K2S2O8同样可以促进Cu (CN)32-中CN-的降解.
|
(a) 不同K2S2O8条件下溶液中铜质量浓度变化;(b) Cu (CN)32-氧化过程中冷冻样品的X射线衍射光谱图 图 4 Cu离子质量浓度的变化和Cu离子转化 Fig. 4 Variation of Cu concentration and transformation of Cu |
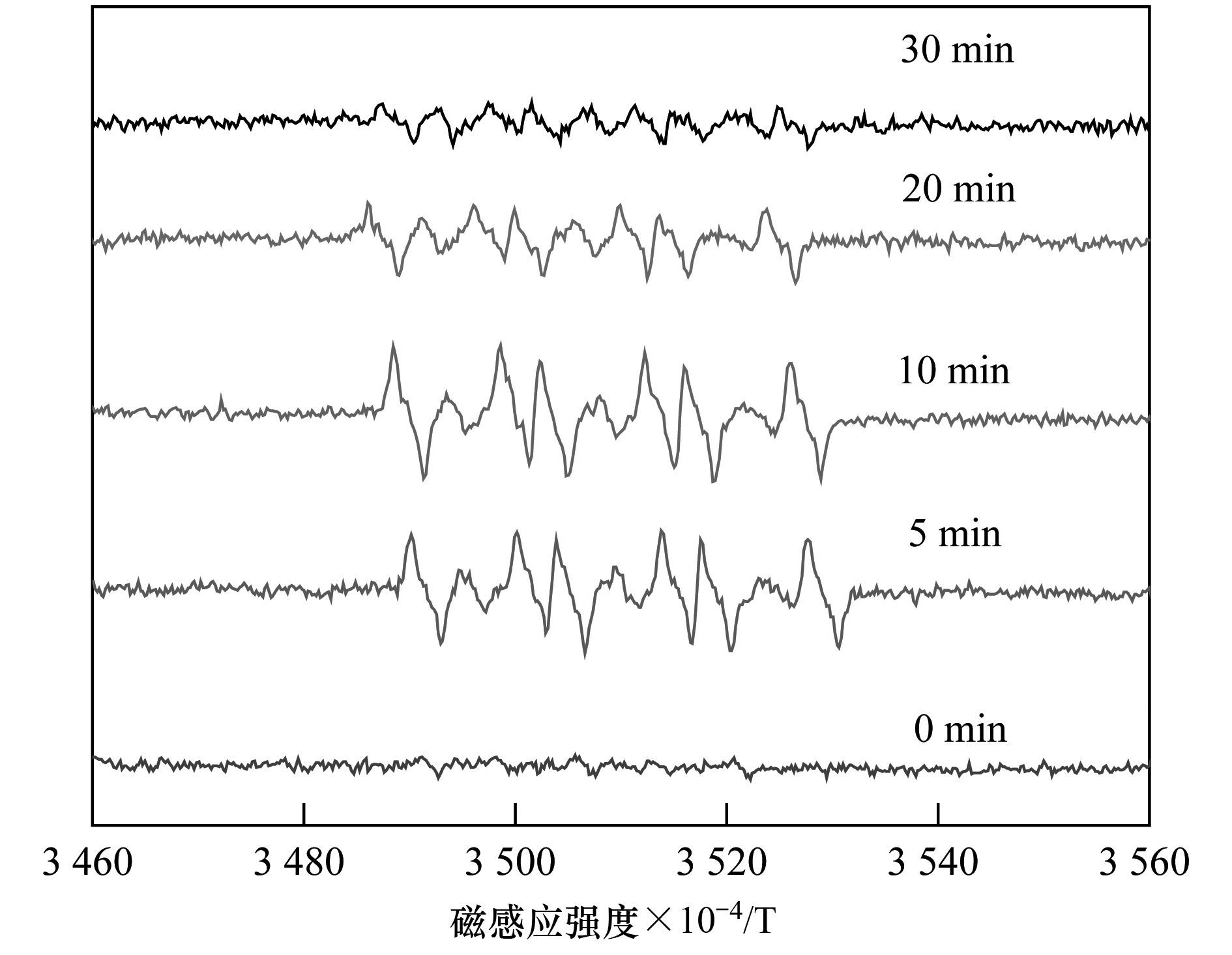
以DMPO为HO·和SO4·-自由基捕捉剂,利用电子顺磁光谱(ESR) 检测了Cu (CN)32-氧化过程中产生的自由基. 图 5为不同反应时刻的ESR谱图,从中可以看出,反应时间为0 min时,没有观察到明显的ESR信号.当反应时间为5.0 min时,可以观察到非常明显的六重峰,其超精细耦合常数aN=13.82×10-4 T,aHβ=10.11×10-4 T,aHγ=1.370×10-4 T,证明反应过程中产生了SO4·-.随着反应时间的进行,DMPO-SO4·-的强度先增强后减弱,在反应10 min时,DMPO-SO4·-峰强度达到最大,10 min后逐渐减弱.然而,从ESR谱图中并没有观测到DMPO-HO·的特征峰,表明反应过程中没有检测到HO·.
|
图 5 DMPO-SO4·-的电子顺磁共振信号变化 Fig. 5 ESR signal of DMPO-SO4·- in aqueous dispersion during the process of Cu (CN)32- oxidation |
据知,SO4·-和HO·一般被认为是活化过硫酸盐过程中的主要氧化物种,并且在中性或碱性条件下,SO4·-可能会转变为HO·[20, 27],反应如方程式(2) 所示:
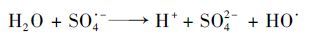
|
(2) |
SO4·-和HO·这两种自由基均可能对氧化去除Cu (CN)32-中CN-起作用.为了更准确地探究何种自由基在反应过程中起主要作用,以乙醇(EtoH) 为SO4·-和HO·自由基的猝灭剂[20],以叔丁醇(TBA) 为HO·猝灭剂进行了自由基猝灭实验[28].结果如图 6所示,加入叔丁醇后Cu (CN)32-中CN-的去除率并没有受到影响,表明HO·在该反应中并非主要的氧化物种;而乙醇的加入却大大降低了Cu (CN)32-中CN-的去除率,表明SO4·-在氧化去除氰根过程中起主要作用.另外,即使加入乙醇后,仍有大约50%的CN-得到去除,表明CN-的去除不仅是由于SO4·-自由基的氧化作用,还有非自由基氧化过程参与到CN-的去除.

|
图 6 乙醇和叔丁醇对Cu (CN)32-中CN-去除的影响 Fig. 6 Influence of EtoH and TBA on CN- degradation |
(1) K2S2O8不能氧化去除游离态CN-,但可以有效氧化去除铜氰络合物中CN-,CN-去除率随K2S2O8投加量的增加而增大,当K2S2O8浓度为2.0 mmol·L-1时,CN-去除率高达89.6%;CN-的去除率随着铜氰络合比的增大而降低.
(2) Cu (CN)32-中的CN-去除后被氧化为CNO-;Cu+最终被氧化为Cu2+,并且以CuO的形式存在于沉淀中.
(3) ESR和自由基猝灭实验表明CN-的去除主要是由于SO4·-自由基氧化和CuO活化K2S2O8的非自由基氧化两种反应途径.对于自由基氧化: Cu+与K2S2O8发生类芬顿反应,生成SO4·-自由基氧化去除CN-;对于非自由基氧化:反应过程中生成的CuO能够活化过硫酸根,该过程虽不产生强氧化性自由基,但可以显著提高K2S2O8自身氧化性,从而氧化去除CN-.
| [1] | Eisler R, Wiemeyer S N. Cyanide hazards to plants and animals from gold mining and related water issues[J]. Reviews of Environmental Contamination and Toxicology, 2004, 183 : 21–54. |
| [2] | 李雪萍, 钟宏, 周立. 含氰废水处理技术研究进展[J]. 化学工业与工程技术, 2012, 33(2) : 17–23. Li X P, Zhong H, Zhou L. Research progress of cyanide-containing wastewater treatment[J]. Journal of Chemical Industry & Engineering, 2012, 33(2) : 17–23. |
| [3] | Pombo F R, Dutra A J B. Copper removal from diluted cyanide wastewater by electrolysis[J]. Environmental Progress & Sustainable Energy, 2013, 32(1) : 52–59. |
| [4] | Botz M M, Mudder T I, Akcil A U. Cyanide treatment:physical, chemical and biological processes[J]. Developments in Mineral Processing, 2005, 15 : 672–702. DOI: 10.1016/S0167-4528(05)15028-5 |
| [5] | Lu J M, Dreisinger D B, Cooper W C. Thermodynamics of the aqueous copper-cyanide system[J]. Hydrometallurgy, 2002, 66(1-3) : 23–36. DOI: 10.1016/S0304-386X(02)00081-6 |
| [6] | Hou Y, Li X Y, Zhao Q D, et al. Role of hydroxyl radicals and mechanism of Escherichia coli inactivation on Ag/AgBr/TiO2 nanotube array electrode under visible light irradiation[J]. Environmental Science & Technology, 2012, 46(7) : 4042–4050. |
| [7] | Gurol M D, Bremen W M. Kinetics and mechanism of ozonation of free cyanide species in water[J]. Environmental Science & Technology, 1985, 19(9) : 804–809. |
| [8] | Wu J L, Wang J L, Liu H Y, et al. Fouling and cleaning of gas-filled membrane for cyanide removal from acrylonitrile wastewater[J]. Desalination and Water Treatment, 2011, 34(1-3) : 382–388. DOI: 10.5004/dwt.2011.2883 |
| [9] | Wu J L, Wang J L, Liu H Y, et al. Removal of cyanide from acrylonitrile wastewater using gas membrane[J]. Water Science & Technology, 2011, 64(11) : 2274–2281. |
| [10] | White D M, Pilon T A, Woolard C. Biological treatment of cyanide containing wastewater[J]. Water Research, 2000, 34(7) : 2105–2109. DOI: 10.1016/S0043-1354(99)00362-0 |
| [11] | Lou J C, Lee S S. Chemical oxidation of BTX using Fenton's reagent[J]. Hazardous Waste and Hazardous Materials, 1995, 12(2) : 185–193. DOI: 10.1089/hwm.1995.12.185 |
| [12] | 顾桂松, 胡湖生, 杨明德. 含氰废水的处理技术最近进展[J]. 环境保护, 2001(2) : 16–19. Gu G S, Hu H S, Yang M D. Recent development of the technologies of cyanide containing wastewater treatment[J]. Environmental Protection, 2001(2) : 16–19. |
| [13] | 张娟娟, 窦远明, 李静, 等. Bi2MoO6薄膜电极光电催化氧化处理氰化物的研究[J]. 环境科学学报, 2015, 35(3) : 738–744. Zhang J J, Dou Y M, Li J, et al. Photoelectrocatalytic oxidation of cyanides at Bi2MoO6 film electrode[J]. Acta Scientiae Circumstantiae, 2015, 35(3) : 738–744. |
| [14] | 薛文平, 薛福德, 姜莉莉, 等. 含氰废水处理方法的进展与评述[J]. 黄金, 2008, 29(4) : 45–50. Xue W P, Xue F D, Jiang L L, et al. Discussion and advances on treatment of wastewater containing cyanide[J]. Gold, 2008, 29(4) : 45–50. |
| [15] | Anipsitakis G P, Dionysiou D D. Radical generation by the interaction of transition metals with common oxidants[J]. Environmental Science & Technology, 2004, 38(13) : 3705–3712. |
| [16] | Johnson R L, Tratnyek P G, Johnson R O. Persulfate persistence under thermal activation conditions[J]. Environmental Science & Technology, 2008, 42(24) : 9350–9356. |
| [17] | Furman O S, Teel A L, Watts R J. Mechanism of base activation of persulfate[J]. Environmental Science & Technology, 2010, 44(16) : 6423–6428. |
| [18] | Guan Y H, Ma J, Li X C, et al. Influence of pH on the formation of sulfate and hydroxyl radicals in the UV/Peroxymonosulfate system[J]. Environmental Science & Technology, 2011, 45(21) : 9308–9314. |
| [19] | Drzewicz P, Perez-Estrada L, Alpatova A, et al. Impact of peroxydisulfate in the presence of zero valent iron on the oxidation of cyclohexanoic acid and naphthenic acids from oil sands process-affected water[J]. Environmental Science & Technology, 2012, 46(16) : 8984–8991. |
| [20] | Zhang T, Chen Y, Wang Y R, et al. Efficient peroxydisulfate activation process not relying on sulfate radical generation for water pollutant degradation[J]. Environmental Science & Technology, 2014, 48(10) : 5868–5875. |
| [21] | Moussavi G, Pourakbar M, Aghayani E, et al. Comparing the efficacy of VUV and UVC/S2O82- advanced oxidation processes for degradation and mineralization of cyanide in wastewater[J]. Chemical Engineering Journal, 2016, 294 : 273–280. DOI: 10.1016/j.cej.2016.02.113 |
| [22] | Chen F Y, Zhao X, Liu H J, et al. Reaction of Cu (CN)32- with H2O2 in water under alkaline conditions:cyanide oxidation, Cu+/Cu2+ catalysis and H2O2 decomposition[J]. Applied Catalysis B:Environmental, 2014, 158-159 : 85–90. DOI: 10.1016/j.apcatb.2014.04.010 |
| [23] | 国家环境保护总局. 水和废水监测分析方法[M]. (第四版). 北京: 中国环境科学出版社, 2002: 88-286. |
| [24] | 王晨曦, 万金泉, 马邕文, 等. 负载型颗粒活性炭催化过硫酸钠氧化降解橙黄G[J]. 环境工程学报, 2015, 9(1) : 213–218. Wang C X, Wan J Q, Ma Y W, et al. Degradation of orange G catalyzed by Fe/GAC in the presence of persulfate[J]. Chinese Journal of Environmental Engineering, 2015, 9(1) : 213–218. |
| [25] | Zhang X L, Feng M B, Qu R J, et al. Catalytic degradation of diethyl phthalate in aqueous solution by persulfate activated with nano-scaled magnetic CuFe2O4/MWCNTs[J]. Chemical Engineering Journal, 2016, 301 : 1–11. DOI: 10.1016/j.cej.2016.04.096 |
| [26] | Wang X, Yang J, Shi L X, et al. Surfactant-free synthesis of CuO with controllable morphologies and enhanced photocatalytic property[J]. Nanoscale Research Letters, 2016, 11 : 125. DOI: 10.1186/s11671-016-1278-z |
| [27] | Ding Y B, Zhu L H, Wang N, et al. Sulfate radicals induced degradation of tetrabromobisphenol a with nanoscaled magnetic CuFe2O4 as a heterogeneous catalyst of peroxymonosulfate[J]. Applied Catalysis B:Environmental, 2013, 129 : 153–162. DOI: 10.1016/j.apcatb.2012.09.015 |
| [28] | 章丹, 徐斌, 朱培娟, 等. TiO2光催化降解亚甲基蓝机理的研究[J]. 华东师范大学学报(自然科学版), 2013(5) : 35–42. Zhang D, Xu B, Zhu P J, et al. Study on the mechanism of methylene blue degradation by TiO2 photocatalyst[J]. Journal of East China Normal University (Natural Science), 2013(5) : 35–42. |
 2017, Vol. 38
2017, Vol. 38


