2. 同济大学环境科学与工程学院, 污染控制与资源化研究国家重点实验室, 上海 200092
2. State Key Laboratory of Pollution Control and Resource Reuse, College of Environmental Science and Engineering, Tongji University, Shanghai 200092, China
溶解有机质(DOM)在自然水体中普遍存在,主要由腐殖质、 多糖、 蛋白质、 酯类和核酸等组分构成. 大部分的DOM组分能够吸收可见和紫外光,被称为有色溶解有机质(CDOM),其中一部分还能在一定的激发波长下产生荧光,被称为荧光溶解有机质(FDOM). 溶解有机质具有高的反应活性,能够与痕量有机污染物、 重金属等发生吸附、 络合及氧化/还原反应[1],它也是消毒副产物前体物质的主要来源[2]. 目前人们研究较多的消毒副产物有三卤甲烷(THMs)、 卤乙酸(HAAs)等卤代烃化合物,而水中DOM的组成对形成不同消毒副产物的贡献有明显的差异[3,4,5]. 通常,消毒副产物前体物是拥有苯环结构的腐殖质、 木质素和丹宁酸等DOM组分,会吸收与其浓度成正比的紫外辐射[6],有研究显示,DOM的比吸收系数(SUVA254)能够较好地反映其芳香性[2].
近年来,N-亚硝基二甲胺(NDMA)作为一种新兴的、 含氮的亚硝胺类消毒副产物,引起了科学家们的广泛关注[7, 8]. 关于消毒过程中NDMA的形成机制,多数人认为NDMA是由其前体物在氯消毒或氯胺消毒过程中发生氧化作用而生成的,水体中的一些溶解性有机质(DOM)是NDMA前体物的重要来源[7]. 在对NDMA生成潜能与不同DOM组分的关系分析中,发现DOM中亲水性碱组分(HPIB)具有最大的单位质量NDMA生成潜能(NDMA-FP); 用SUVA254预测NDMA的生成潜能时结果并不理想; 在DOM荧光强度变化与NDMA的形成研究上也没有找到定量关系[9, 10]. 因此,本研究拟通过多种技术手段,包括利用平行因子分析(PARAFAC)将复杂的DOM分成分解为类蛋白、 类腐殖质等荧光组分,试图在分析不同光学特性的DOM组分与NDMA生成潜能的关系上取得些突破.
2012年2~12月,每两个月一次对黄浦江上游至下游11个点位的表层水样进行采集. 采集后的水样带回实验室,用0.7 μm孔径的玻璃纤维滤膜(Whatman GF/F,450℃ 预灼4 h)进行过滤,并存于棕色瓶内避光室温培养.
取适量GF/F过滤水样再经0.22 μm的醋酸纤维酯膜(Millipore 公司)过滤后,进行紫外吸收、 荧光光谱和总有机碳测定,经28 d室温培养的水样亦做上述测定. 具体如下.
(1)紫外吸收光谱测定 用双光束紫外-可见分光光度计(北京普析通用TU-1901仪器,5 cm比色皿)对样品进行吸收光谱扫描,波长扫描范围800~200 nm. 根据公式aλ=2.303×A(λ)/L计算吸收系数aλ (m-1),式中λ为波长(nm),A(λ)为特定波长处吸光度,L为比色皿的光程. 比吸收系数SUVA254是指物质在254 nm处的吸光度与DOC的比值,它能够很好地反映芳香性碳的含量[2]. E2/E3用来表示250 nm波长处吸光度与365 nm波长处吸光度的比值,其值的大小与DOM分子量的大小呈反比[11].
(2)荧光光谱测定 用荧光光谱分析仪(F-4500,日本日立公司)对样品进行三维光谱(EEM)扫描,扫描范围 Ex/Em=240~400 nm/300~550 nm,步长分别为3 nm和2 nm; 样品光谱数据经过扣除空白和拉曼归一化处理后,进行平行因子分析(MATLAB Ver. 7.7.0),获得荧光组分[12]. 腐殖化指数(HIX)用于表征DOM的腐殖化程度,定义为254 nm激发波长下,发射波长在435~480 nm 与300~345 nm 波段内的荧光强度积分值的比率; 生物源指数(BIX)用于衡量新近水生生物生产的贡献,即310 nm激发波长下,发射波长在380 nm与430 nm处荧光强度的比值[13, 14]. 实验中所用空白均为超纯水.
(3) 溶解有机碳(DOC)测定 将过滤后的样品酸化至pH 2~3,用总有机碳分析仪(TOC-VCPN, 日本岛津)测定DOC浓度,待炉温升至720℃,基线稳定后,每个样品测定2~3次. 由于样品DOC浓度较低,采用不可吹扫有机碳(NPOC)的方法进行测定.
采用高效液相色谱质谱联用仪(HPLC-MS/MS)进行检测[15, 16]. ①取适量GF/F滤液经过0.45 μm孔径的醋酸纤维酯膜(Millipore公司)过滤,获得的250 mL滤液与5 mL 0.1 mol ·L-1一氯胺溶液(有效氯为4 mmol ·L-1)反应10 d,然后0.48 mL 0.568 mol ·L-1抗坏血酸终止反应,将此阶段内产生的NDMA的总浓度作为NDMA -FP. ②用XDB C18柱(150 mm×2.1 mm×3.5 μm; Agilent)对0.45 μm滤液以及反应10 d后的样品分别进行NDMA的固相萃取,萃取速度控制在10 mL ·min-1. 采用美国EPA521推荐的NDMA固相萃取标准方法,用15 mL二氯甲烷将其洗脱下来. 再向洗脱液中加入1 mL 100 ng ·mL-1的NDMA-d6作为内标,在室温条件下,用氮气将洗脱液浓缩至1 mL,加0.5 mL超纯水,再将接受瓶置于45℃水浴中加热15 min,直到洗脱液中的二氯甲烷完全挥发,最后加超纯水定容至1 mL,进行HPLC-MS/MS测定. ③色谱条件:色谱柱为Agilent XDB-C18柱(150 mm×2.1 mm×3.5 μm). 流动相:甲醇(A)和2 mmol ·L-1醋酸铵水溶液(B). 梯度洗脱:0~4 min,A由10%至45%,B由90%至55%; 4~5 min,A由45%升至100%,B由55%降至0%; 10~11 min,A由100%降至10%,B由0%升至90%; 保持至13 min. 流速:150 μL ·min-1. 进样量:10 μL. 柱温:30℃. 质谱条件:ESI源正离子电离模式; SRM扫描模式; 喷雾电压为4 500 V; 离子源温度为375℃; 保护气N2和辅助气N2压力分别为40 AU和8 AU; 碰撞气为氩气,碰撞气压1.5 m Torr. NDMA出峰时间为3.35 min,NDMA-d6的出峰时间为3.32 min.
黄浦江表层水溶解有机质的光谱特征参数如表 1所示. 从2~12月,黄浦江DOC的浓度在2.93~5.94 mg ·L-1之间变化,呈冬高夏低的趋势,一方面冬季属于枯水期,水量较小; 另一方面夏季光照强、 温度高,DOC发生光解以及被微生物利用的效率也大大提高. a355值在3.45~4.73 m-1之间变化,我国大多数河流和淡水湖泊中溶解有机质的吸收系数也分布在这个范围内[17]. 黄浦江水中DOM的HIX值在0.41~0.90范围内(<1.5),BIX值在1.05~1.35范围内(>1)变化,可以认为黄浦江DOM基本上以新近的生物源组分为主[18]. 另外a355值和SUVA254在8月均达到一个最大值,这可能与夏季旺盛的初级生产力有关,因为藻类释放以及高等植物腐烂是水体DOM的重要来源. 同时,这也从侧面说明了黄浦江DOM的新近生物源性质.
| 表 1 黄浦江溶解有机质的紫外吸收和荧光光谱特征参数 1) Table 1 UV absorption and fluorescence characteristics of DOM in the Huangpu River |
如图 1所示,对247组EEM数据进行平行因子分析,得到了类酪氨酸C1(Ex/Em=280 nm/319 nm)、 类色氨酸C2(Ex/Em=240,289 nm/350 nm)、 类色氨酸C4(Ex/Em=289 nm/340 nm)等3种类蛋白组分和一种类腐殖质组分C3(Ex/Em=256 nm,316 nm/437 nm)[19]. 通过培养实验发现,C1、 C2和C3属于微生物难降解组分,而C4中的一部分可被微生物利用(暂未发表数据). 早期研究认为小分子的物质容易被微生物利用,但后来有研究表明微生物更倾向于优先利用大分子物质[20],小分子物质则为大分子物质降解后的产物,外部条件不变的情况下,其再度被利用的可能性很小. 另外,本研究还观察到培养后的水样,其DOM的E2/E3值稍微有些升高(见表 1),说明培养后DOM分子量降低[11],表明在培养的过程中,大分子的物质被微生物优先分解了.
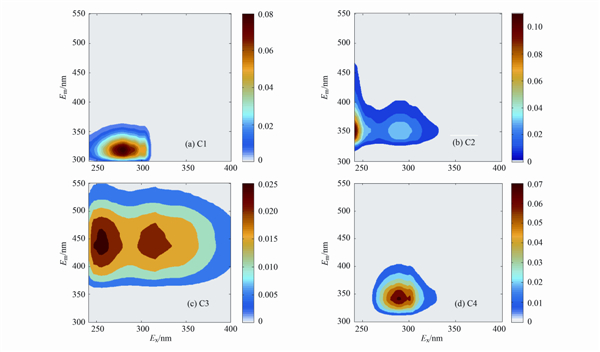 | 图 1 PARAFAC分析得到的荧光组分 Fig. 1 Fluorescent components decomposed by PARAFAC |
一般认为,在DOC含量高于3 mg ·L-1,SUVA254值大于 2~3 L ·(mg ·m)-1 的水体中,消毒副产物的生成潜能与CDOM有着很好的相关性[21]. 在本研究中发现,NAMA-FP浓度与DOC浓度呈显著正相关,而与SUVA254呈显著负相关(见表 2),表明DOM中参与生成消毒副产物NDMA的物质芳香性较低,亲水性有机物中低芳香性化合物对消毒副产物的生成贡献较大些,与Ndiongue等[22]的研究结果相符. 但是也不排除苯环作为氯化反应的活性官能团与氯胺发生卤代反应,楚文海等[23]发现酪氨酸作为氯仿的前体物,与氯胺发生卤代反应,而使紫外光谱吸收发生蓝移. NDMA与a355呈显著负相关,与比吸收系数的相关性则很小. 这可能是因为卤化降低了疏水性酸的芳香性,并导致其分子分解成更小的片段[24],如对氯苯酚,氨基酸,对氯甲基苯酚等,从而减弱了其在355 nm波长处的吸收.
| 表 2 NDMA及其前体物与DOM光学特性的相关性 1) Table 2 Relationship between NDMA, NDMA-FP and the optical properties of DOM |
但是,Weishaar等[2]、 Chen等[10]、 Ates等[21]认为,SUVA254作为衡量消毒副产物生成潜能的指标,并不十分可靠. 这些研究多集中在与三氯甲烷以及卤乙酸等消毒副产物的关系上. 一方面SUVA254很难说明水样间的差异,不能表明研究水体的地质、 物理和环境因素(营养状态、 流域土壤特性和土地利用特征、 湖泊大小、 河流流量等)的状况,而这些因素往往决定了DBP前体的差异. 另一方面非芳香性组分也可能会参与形成消毒副产物. 例如叶绿素、 蛋白质等物质在254 nm处没有吸收或吸收很小[2]. 还有一些研究尝试用基于SUVA254的模型来预测不同水样中消毒副产物的生成潜能,但对NDMA的预测结果不理想[10, 25]; 因为水体中的一些离子或者氨基类化合物也会成为影响模型的因素. 所以在选择单独使用SUVA254来衡量水体消毒副产物尤其是含氮消毒副产物生成潜能时,依然需要谨慎.
自然水体中可通过亚硝化过程生成NDMA,这种转化机制中NDMA-FP被基本限定为二甲胺和含有二甲胺的叔胺等物质; 自由氯和氯胺会促进这一亚硝化过程的进行,其本身也会与DOM发生反应[7, 15]. 本研究发现NDMA-FP浓度与类酪氨酸和类色氨酸荧光强度有着显著的正相关性,而与类腐殖质的荧光强度呈显著负相关(见表 2). 氨基酸类物质含有1个或多个—NH2,在氯胺消毒过程中,极有可能经过一系列反应形成NDMA[26, 27]. 而类腐殖质中含有较多的苯环,芳香性较高,并不是直接与氯胺发生反应生成NDMA的主要物质. 已有研究发现黄浦江中NDMA前体物主要以相对分子质量<1 000的有机物为主,而这些有机物又主要以小分子的游离氨基化合物为主[28]. 结合DOM的紫外吸收特征,推断黄浦江NDMA-FP可能是小分子的低芳香性的氨基酸类物质. 虽然微生物对此类物质的作用很小,但在自然条件下,光照也是一个重要的影响因素. 在光照作用下,这些小分子物质发生光解,从而能够被微生物再度利用. 另外DOM在光照的作用下大部分反应基团会受到破坏,其SUVA254和荧光强度值能随着光照的时间增加而迅速下降(未发表数据). 光照也能降解痕量NDMA, 在自来水和江水为背景的2种对比体系中,光解NDMA去除率分别可达96.7%和94.8%[29]. 夏季,黄浦江水中DOC的浓度,类酪氨酸和类色氨酸的含量以及NAMA-FP的浓度都要低于冬季,一方面可归功于丰水期的稀释作用,另一方面这类物质很容易发生光漂白作用[30],从而降低了其生成NDMA的潜力.
如果单独使用SUVA254来分析水体中NDMA的生成潜能不是很可靠,那么将它和荧光的相关指标结合起来,则可以说明一定的问题. HIX的大小常被用来衡量DOM成熟度的高低[31]. 在本研究中发现,NDMA及其生成潜能均与HIX呈显著负相关,也就是说随着腐殖化指数的升高,NDMA前体物质的浓度会下降. 说明在DOM趋于老化的过程中(微生物和光照的作用),它与氯消毒剂或者亚硝酸盐作用形成NDMA的能力会逐渐减弱. 通常在无外源输入时,水体中DOM就会逐渐趋于老化. 因此在饮用水处理中,建议加氯前使用紫外光接触或太阳光辐照,以降低DOM的反应性,削弱其生成NDMA的能力.
黄浦江水体NDMA生成潜能随河水中溶解有机质含量增加而增加,其前体物并不是类腐殖质物质,而主要是分子量相对较低的类酪氨酸和类色氨酸物质; NDMA生成潜能随DOM的芳香性和腐殖化程度增强而减少; 在饮用水处理工艺中,若在氯胺消毒处理之前进行一定的光辐照处理,有可能大大降低NDMA的生成潜能.
| [1] | Aiken G, Haitzer M, Ryan J N, et al. Interactions between dissolved organic matter and mercury in the Florida Everglades[J]. Journal de Physique Ⅳ (Proceedings), 2003, 107: 29-32. |
| [2] | Weishaar J L, Aiken G R, Bergamaschi B A, et al. Evaluation of specific ultraviolet absorbance as an indicator of the chemical composition and reactivity of dissolved organic carbon[J]. Environmental Science and Technology, 2003, 37 (20): 4702-4708. |
| [3] | 赵玉丽, 李杏放. 饮用水消毒副产物: 化学特征与毒性[J]. 环境化学, 2011, 30 (1): 20-33. |
| [4] | Marhaba T F, Van D. The variation of mass and disinfection by-product formation potential of dissolved organic matter fractions along a conventional surface water treatment plant[J]. Journal of Hazardous Materials, 2000, 74 (3): 133-147. |
| [5] | 罗锦洪, 付青, 郑丙辉, 等. 水华期水体中DOM组成及其消毒副产物生成潜能[J]. 应用基础与工程科学学报, 2012, 20 (2): 210-218. |
| [6] | 陈超, 张晓健, 何文杰, 等. 消毒副产物前体物的指标体系[J]. 中国给水排水, 2006, 22 (4): 9-12. |
| [7] | 张强, 刘燕, 张云, 等. 饮用水含氮消毒副产物N-亚硝基二甲胺前体物研究进展[J]. 化学通报, 2011, 74 (9): 817-821. |
| [8] | Choi J, Valentine R L. Formation of N-nitrosodimethylamine (NDMA) from reaction of monochloramine: a new disinfection by-product[J]. Water Research, 2002, 36 (4): 817-824. |
| [9] | Chen Z, Valentine, R L. Formation of N-Nitrosodimethylamine (NDMA) from humic substances in natural water[J]. Environmental Science and Technology, 2007, 41 (17): 6059-6065. |
| [10] | Chen B Y, Westerhoff P. Predicting disinfection by-product formation potential in water[J]. Water Research, 2010, 44 (13): 3755-3762. |
| [11] | 黄清辉, 吴加学, 蒋愉林, 等. 舟山海域陆源溶解有机质变化及其对近岸羽状流的响应[J]. 海洋学报(中文版), 2011, 33 (1): 66-73. |
| [12] | Stedmon C A, Bro R. Characterizing dissolved organic matter fluorescence with parallel factor analysis: a tutorial[J]. Limnology and Oceanography: Methods, 2008, 6: 572-579. |
| [13] | Zhang Y, Zhang E, Yin Y, et al. Characteristics and sources of chromophoric dissolved organic matter in lakes of the Yungui Plateau, China, differing in trophic state and altitude[J]. Limnology and Oceanography, 2010, 55 (6): 2645-2659. |
| [14] | Huguet A, Vacher L, Relexans S, et al. Properties of fluorescent dissolved organic matter in the Gironde Estuary[J]. Organic Geochemistry, 2009, 40 (6): 706-719. |
| [15] | Munch J W, Bassett M V. Method 521 determination of nitrosamines in drinking water by solid phase extraction and capillary column gas chromatography with large volume injection and chemical ionization tandem mass spectrometry (MS/MS)[R]. National Exposure Research Laboratory, Office of Research and Development, 2004. EPA Document #: EPA/600/R-05/054. |
| [16] | Lv J, Li Y, Song Y. Reinvestigation on the ozonation of N-nitrosodimethylamine: Influencing factors and degradation mechanism[J]. Water Research, 2013, 47 (14): 4993-5002. |
| [17] | 陈锡超, 纪颖琳, 胡青, 等. "引江济太"水系有色溶解有机质的特征与来源[J]. 湖泊科学, 2010, 22 (1): 63-69. |
| [18] | 蔡明红, 肖宜华, 王峰, 等. 北极孔斯峡湾表层沉积物中溶解有机质的来源与转化历史[J]. 海洋学报(中文版), 2012, 34 (6): 102-113. |
| [19] | Henderson R K, Baker A, Murphy K R, et al. Fluorescence as a potential monitoring tool for recycled water systems: A review[J]. Water Research, 2009, 43 (4): 863-881. |
| [20] | Amon R M W, Benner R. Bacterial utilization of different size classes of dissolved organic matter[J]. Limnology and Oceanography, 1996, 41 (1): 41-51. |
| [21] | Ates N, Kitis M, Yetis U. Formation of chlorination by-products in waters with low SUVA—correlations with SUVA and differential UV spectroscopy[J]. Water Research, 2007, 41 (18): 4139-4148. |
| [22] | Ndiongue S, Huck P M, Slawson R M. Effects of temperature and biodegradable organic matter on control of biofilms by free chlorine in a model drinking water distribution system[J]. Water Research, 2005, 39 (6): 953-964. |
| [23] | 楚文海, 高乃云, 赵世嘏, 等. 在饮水中典型溶解性有机氮酪氨酸氯化生成氯仿的机理分析[J]. 化学学报, 2009, 67 (21): 2505-2510. |
| [24] | Korshin G V, Kumke M U, Li C W, et al. Influence of chlorination on chromophores and fluorophores in humic substances[J]. Environmental Science and Technology, 1999, 33 (8): 1207-1212. |
| [25] | Sadiq R, Rodriguez M J. Disinfection by-products (DBPs) in drinking water and predictive models for their occurrence: a review[J]. Science of the Total Environment, 2004, 321 (1): 21-46. |
| [26] | Andrzejewski P, Kasprzyk-Hordern B, Nawrocki J. N-nitrosodimethylamine (NDMA) formation during ozonation of dimethylamine-containing waters[J]. Water Research, 2008, 42 (4): 863-870. |
| [27] | Lee W, Westerhoff P, Croué J P. Dissolved organic nitrogen as a precursor for chloroform, dichloroacetonitrile, N-nitrosodimethylamine, and trichloronitromethane[J]. Environmental Science and Technology, 2007, 41 (15): 5485-5490. |
| [28] | 林琳, 徐斌, 覃操, 等. 黄浦江原水NDMA前体物的组成规律及其在常规净水工艺中的削减特性[J]. 给水排水, 2013, 39 (2): 61-65. |
| [29] | 徐冰冰, 陈忠林, 齐飞, 等. 紫外光降解水中痕量NDMA的效能研究[J]. 环境科学, 2008, 29 (7): 1908-1913. |
| [30] | Moran M A, Sheldon W M, Zepp R G. Carbon loss and optical property changes during long-term photochemical and biological degradation of estuarine dissolved organic matter[J]. Limnology and Oceanography, 2000, 45 (6): 1254-1264. |
| [31] | Zsolnay A, Baigar E, Jimenez M, et al. Differentiating with fluorescence spectroscopy the sources of dissolved organic matter in soils subjected to drying[J]. Chemosphere, 1999, 38 (1): 45-50. |
 2014, Vol.
2014, Vol. 


